Unterschied zwischen True und Potential Elektrolyt
Der Schlüsselunterschied Zwischen wahrer und potenzieller Elektrolyt ist das True Elektrolyte dissoziieren sich vollständig in Ionen, während potenzielle Elektrolyte teilweise zu Ionen dissoziieren.
Wir können alle Verbindungen in zwei Gruppen als Elektrolyte und Nichtelektrolyte kategorisieren, abhängig von ihrer Fähigkeit, Ionen zu produzieren und Elektrizität zu leiten. Elektrolyse ist der Prozess, einen Strom durch eine elektrolytische Lösung zu übergeben und positive und negative Ionen zu zwingen, sich in Richtung ihrer jeweiligen Elektroden zu bewegen. Nichtelektrolyten können nicht an Elektrolyseprozessen teilnehmen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist wahrer Elektrolyt
3. Was ist potenzieller Elektrolyt
4. Seite an Seite Vergleich - True vs Potential Electrolyt in tabellarischer Form
5. Zusammenfassung
Was ist wahrer Elektrolyt?
Wahre Elektrolyte sind die Substanz, die sich vollständig in seine Ionen diskutieren kann. Diese werden auch als als benannt Starke Elektrolyte. Diese Verbindungen produzieren leicht ihre ionischen Formen, wenn sie in Wasser oder einer anderen Lösung gelöst werden. Es gibt sowohl Kationen als auch Anionen in der Lösung, nachdem die Verbindung dissoziiert wurde; Somit können diese Ionen einen elektrischen Strom durch die elektrolytische Lösung tragen. Dies ist der Grund für seinen Namen „Elektrolyt“, was „Fähigkeit zur Leitung von Elektrizität“ bedeutet, dass.
Eine konzentrierte Lösung eines echten Elektrolyten hat einen niedrigen Dampfdruck als reines Wasser bei einer ähnlichen Temperatur. Starke Säuren, starke Basen, lösliche ionische Salze, die keine schwachen Säuren und Basen sind, können als echte Elektrolyte klassifiziert werden.

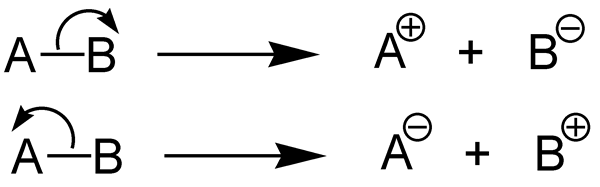
Abbildung 01: Vollständige Dissoziation
Beim Schreiben der chemischen Reaktion für die Ionisierung eines echten Elektrolyten können wir einen einzelnen Pfeil in eine Richtung verwenden, um die vollständige Ionisationsreaktion im Gegensatz zu Potential oder schwachen Elektrolyten zu zeigen. Dieser einzelne Pfeil bedeutet, dass die Reaktion vollständig auftritt. True Elektrolyte können Strom nur dann leiten, wenn in geschmolzener oder lösungsbedingter Zustand. Da die Ionisierung hoch ist, ist die Spannung, die ein wahrer Elektrolyt produzieren kann, sehr hoch.
Was ist potenzieller Elektrolyt?
Potenzielle Elektrolyte sind die Substanzen, die teilweise in seine Ionen dissoziieren können. Dies bedeutet, dass es sich in einer wässrigen Lösung nicht vollständig in seine Ionen verteilen kann. Daher enthält die wässrige Lösung eines potentiellen Elektrolyt. Normalerweise beträgt die Dissoziation eines potenziellen Elektrolyten etwa 1-10%. Diese werden auch als schwache Elektrolyte bezeichnet. Einige häufige Beispiele für schwache Elektrolyte sind Essigsäure, Kohlensäuresäure, Ammoniak, Phosphorsäure usw. Dies sind entweder schwache Säuren oder schwache Basen.
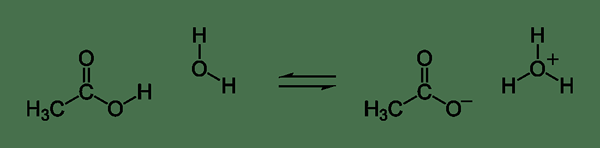
Abbildung 02: Chemische Reaktion zur Dissoziation von Essigsäure
Beim Schreiben der chemischen Reaktion zur Dissoziation eines schwachen Elektrolyten verwenden wir zwei halbe Pfeile, die in entgegengesetzte Richtungen richten. Dieser Pfeil bedeutet, dass es ein Gleichgewicht zwischen den ionischen Spezies und organisierten Molekülen in der wässrigen Lösung gibt.
Was ist der Unterschied zwischen wahrem und potenziellem Elektrolyt?
Abhängig von ihrer Fähigkeit, Ionen zu produzieren und Elektrizität zu leisten, können wir alle Verbindungen als Elektrolyte und Nichtelektrolyte in zwei Gruppen kategorisieren. Elektrolyte werden wieder in zwei Teile als wahre und potenzielle Elektrolyte unterteilt. Der Schlüsselunterschied zwischen True und Potential Electrolyt besteht darin, dass echte Elektrolyte vollständig in Ionen diskutieren, während potenzielle Elektrolyte teilweise zu Ionen dissoziieren. Darüber hinaus beträgt die Dissoziationsstärke von echten Elektrolyten 100%, während die Dissoziationsstärke potenzieller Elektrolyte von 1 bis 10% variiert.
Die folgende Tabelle fasst den Unterschied zwischen True und Potential Electrolyt zusammen.
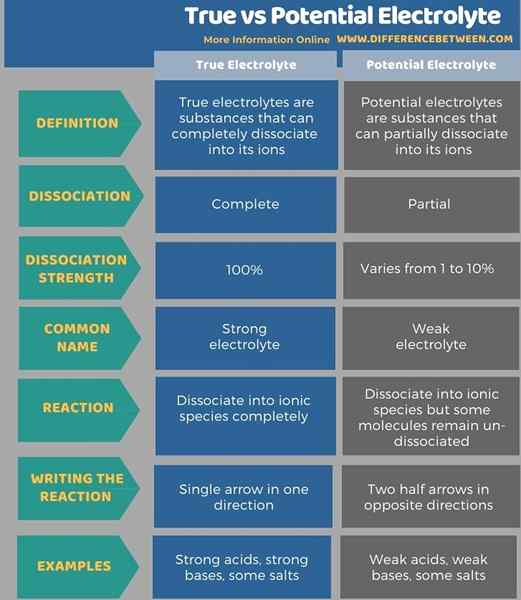
Zusammenfassung -True vs Potential Electrolyt
Echte Elektrolyte sind die Substanz, die sich vollständig in seine Ionen diskutieren kann, während potenzielle Elektrolyte die Substanzen sind. Daher besteht der Hauptunterschied zwischen True und Potential Electrolyt darin, dass echte Elektrolyte sich vollständig in Ionen diskutieren, während potenzielle Elektrolyte teilweise zu Ionen dissoziieren.
Referenz:
1. Helmenstine, Todd. „Schwache Elektrolytdefinition und Beispiele.”Thoughtco, Februar. 11, 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Heterolyse (Chemie)" von Jürgen Martens (CC BY-SA 3.0) über Commons Wikimedia
2. "Acetic-Sacid-Dissociation-2D" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


