Unterschied zwischen volumetrischer und gravimetrischer Analyse
Der Schlüsselunterschied Zwischen volumetrischer und gravimetrischer Analyse befindet sich die Die volumetrische Analyse misst die Menge eines Analyten unter Verwendung von Volumen, während die gravimetrische Analyse die Menge eines Analyten mit Gewicht misst.
In einer Analyse messen wir die Menge einer unbekannten Verbindung unter Verwendung einer bekannten Menge einer bekannten Verbindung. Wir können diese Menge als Volumen oder als Gewicht nehmen. Wenn es sich um ein Volumen handelt, nennen wir es "volumetrische Analyse" oder "Titrimetrische Analyse”. Wenn es Gewicht ist, nennen wir es "gravimetrische Analyse". Beide sind quantitative analytische Techniken, da diese Techniken die Menge einer Probe messen können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist volumetrische Analyse
3. Was ist eine gravimetrische Analyse
4. Seite an Seite Vergleich - Volumetrien gegen gravimetrische Analyse in tabellarischer Form
5. Zusammenfassung
Was ist volumetrische Analyse?
Die volumetrische Analyse ist eine Art quantitativer Analyse, bei der wir die Menge einer unbekannten Verbindung unter Verwendung ihres Volumens messen können. Wir können Titrationen für diesen Zweck verwenden. Daher nennen wir diese Analyse eine „titrimetrische Analyse“. In einer Titration verwenden wir eine zweite Lösung oder ein Reagenz für die Bestimmung des Volumens der in einer Probe vorhandenen unbekannten Verbindung. Durch die Bestimmung des Volumens des Unbekannten können wir die Konzentration dieser Verbindung in der Probe bestimmen.
Volumetrische Analyse für eine Titration
Für eine Titration gibt es im experimentellen System mehrere Komponenten, die wir benötigen. Zu diesen Komponenten gehören eine Bürette, eine Bürette, einen Becherglas oder ein Erlenmeyer -Kolben und Pipetten. Typischerweise füllen wir das Reagenz (eine bekannte Konzentration) in die Bürette und sollten die Probe (mit der unbekannten Verbindung) in den Becherer (ein bekanntes Volumen) einnehmen (ein bekanntes Volumen). Darüber hinaus sollten wir Indikatoren für die Bestimmung des Endpunkts der Titration verwenden. Darüber hinaus ist es wichtig, den richtigen Indikator für eine bestimmte Titration gemäß dem pH -Bereich zu wählen, in dem wir die Titration durchführen. Bsp.: Der Indikator Phenolphthalein funktioniert im pH -Bereich von 8.3-10.0. Der Indikator gibt eine Farbänderung am Endpunkt an. Beispiel: Die Farbe des Phenolphthaleins bei pH 8.3 ist farblos und bei pH 10.0, es zeigt eine hellrosa Farbe.

Abbildung 01: eine Säure-Base-Titration
Darüber hinaus sollte das zweite Reagenz, das wir in die Bürette füllen, eine beträchtliche Reaktion haben, um einen Endpunkt zu geben (es sei denn, es gibt keinen Endpunkt oder eine Änderung der Farbe des Indikators an). Was wir messen, ist das Volumen des Reagens (in der Bürette), das mit der Verbindung in der Probe reagiert. Wir können stöchiometrische Beziehungen verwenden, um die Mol der in der Stichprobe vorhandenen Maulwürfe mit der folgenden Gleichung zu bestimmen.
C1v1 = C2v2
Hier ist C1 die Konzentration des Reagens in der Bürette, V1 ist das Volumen des Reagens, das mit der Probe reagiert, C2 die unbekannte Konzentration der Probe und V2 das Volumen der Probe, die wir in das Becher aufgenommen haben für die Analyse.
Was ist eine gravimetrische Analyse?
Die gravimetrische Analyse ist eine Art quantitativer Analyse, bei der wir das Gewicht einer unbekannten Verbindung in einer Probe bestimmen können. Diese Methode umfasst Niederschlagsreaktionen zur Trennung der gewünschten Verbindung von einer Probe. Eine Niederschlagsreaktion kann eine gelöste Verbindung in einen Niederschlag umwandeln, den wir wiegen können. Wenn die Probe eine Mischung aus mehreren Festststoffen ist, können wir zuerst die Probe in einem geeigneten Lösungsmittel auflösen und dann ein geeignetes Reagenz hinzufügen, das die benötigte Verbindung auslösen kann. Wir nennen es einen auslösenden Agenten. Schließlich können wir den Niederschlag über Filtration trennen und wiegen.
Am wichtigsten ist, dass das ausfällige Mittel nur die erforderliche Verbindung ausführen sollte. Zusätzlich sollte die Filtration des ALLE anderen Bestandteile als die erforderliche Verbindung abwaschen. Für die Entfernung unerwünschter Bestandteile, die immer noch auf dem Niederschlag vorhanden sind, können wir den Niederschlag mit Wasser oder einem anderen Lösungsmittel waschen, das den Niederschlag nicht auflöst. Dann können wir den Niederschlag trocknen und wiegen.

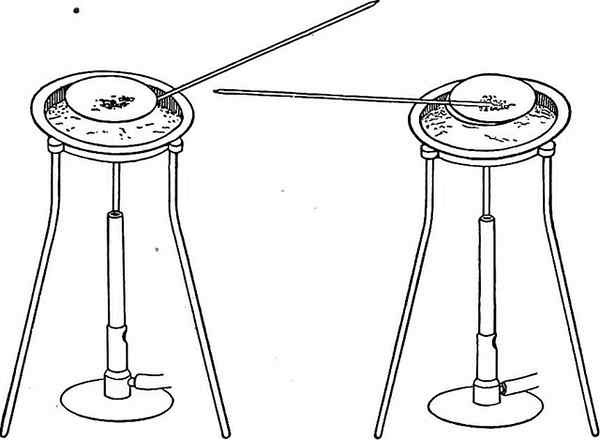
Abbildung 02: Verdunstung von flüchtigen Verbindungen, um den Niederschlag zu isolieren
Abgesehen von der Ausfällung können wir eine Verbindung analysieren, indem wir die flüchtigen Komponenten in der Probe bei einer geeigneten Temperatur verdampfen. Wir können dies tun, indem wir die Probe entweder erhitzen oder chemisch zerlegen. Die Verflüchtigung kann entweder direkt oder indirekt sein. Zündung ist ein Beispiel für eine direkte Methode. Ein Beispiel für eine indirekte Methode ist die Messung des Verlusts des Wassergehalts aus der Probe während der Wärmebehandlung.
Was ist der Unterschied zwischen volumetrischer und gravimetrischer Analyse?
Die volumetrische Analyse ist eine Art quantitativer Analyse, bei der wir die Menge einer unbekannten Verbindung unter Verwendung ihres Volumens messen können. Es misst das Volumen der gewünschten Verbindung in den Einheiten des Volumens wie L (Liter), ML, M3 oder dm3. Die gravimetrische Analyse ist eine Art quantitativer Analyse, bei der wir das Gewicht einer unbekannten Verbindung in einer Probe bestimmen können. Es misst die Masse der gewünschten Verbindung in den Einheiten von MAS wie Mg, G und Kg. Dies ist der Hauptunterschied zwischen volumetrischer und gravimetrischer Analyse.
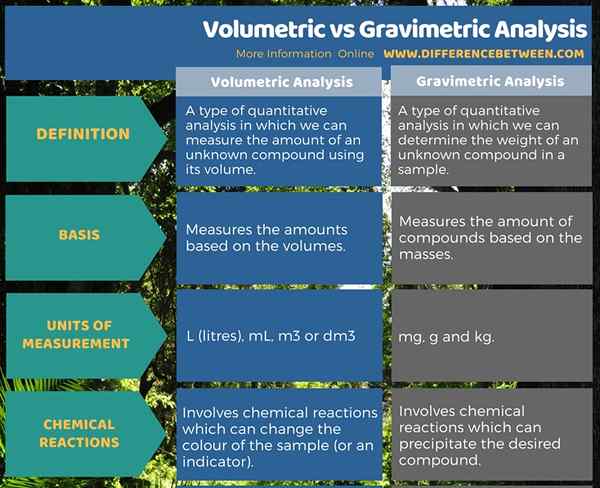
Zusammenfassung -volumetrische gegen gravimetrische Analyse
Wir können die Menge einer Verbindung bestimmen, die in einer bestimmten Probe entweder unter Verwendung der volumetrischen Analyse oder der gravimetrischen Analyse vorhanden ist. Der Unterschied zwischen volumetrischer und gravimetrischer Analyse besteht darin, dass die volumetrische Analyse (oder Titrimetrische Analyse) misst die Menge eines Analyt.
Referenz:
1. Britannica, die Herausgeber von Encyclopaedia. „Volumetrische Analyse.”Encyclopædia Britannica. Encyclopædia Britannica, Inc., 24. Juni 2014. Hier verfügbar
2. Britannica, die Herausgeber von Encyclopaedia. „Gravimetrische Analyse.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 17 Apr. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Phenolphthalein in Flask'by 384 - eigene Arbeit, (CC BY -SA 4.0) über Commons Wikimedia
2.'14765613865' von Internet Archive Book Images über Flickr


