Unterschied zwischen schwacher Säure und verdünnter Säure
Der Schlüsselunterschied zwischen schwacher Säure und verdünnter Säure ist das Schwache Säure ist eine Verbindung, die teilweise dissoziiert, wenn sie in Wasser gelöst werden, während verdünnte Säure eine Lösung ist, die mehr Wasser als Säure enthält.
Eine Säure ist eine Verbindung, die in Wasser dissoziieren kann, um Protonen (Wasserstoffionen) freizusetzen, um sie freizusetzen. Daher haben Säuren einen pH -Wert von weniger als 7. Es gibt zwei Arten von Säuren als starke Säuren und schwache Säuren nach Säurestärke. Nach der Konzentration der Säure gibt es jedoch zwei Arten von Säurelösungen als konzentrierte Säure und verdünnte Säure.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist schwache Säure
3. Was ist verdünnte Säure
4. Seite an Seite Vergleich - schwache Säure gegen verdünnte Säure in tabellarischer Form
5. Zusammenfassung
Was ist eine schwache Säure?
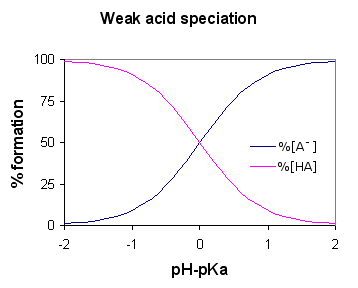
Eine schwache Säure ist eine Verbindung, die sich teilweise in ihre Ionen dissoziiert, wenn sie in Wasser gelöst ist. Schwache Hilfe ist die konjugierte Säure einer schwachen Base. Darüber hinaus hat eine schwache Säure einen hohen pH -Wert im Vergleich zu einer starken Hilfe derselben Konzentration. Beim Schreiben der chemischen Gleichung zur Dissoziation einer schwachen Säure verwenden wir einen Doppelpfeil, um sowohl Vorwärts- als auch Rückwärtsreaktionen einzuschließen, da die Dissoziation einer schwachen Säure reversibel ist.

Abbildung 01: Speziation einer schwachen Säure (AH ist die schwache Säure)
Eine schwache Säure wird aufgrund der weniger polaren Natur der Säureverbindung schwach; Wenn die Verbindung polarer ist, können die Protonen das Säuremolekül leicht verlassen, aber hier ist es schwierig, die chemischen Bindungen abzubauen, da die Verbindung weniger polar ist. Einige Beispiele für schwache Säuren sind Essigsäure, Ameisensäure, HF -Säure, Wasserstoffsulfid usw.
Was ist eine verdünnte Säure?
Verdünnungssäure ist eine wässrige Lösung mit einer geringen Säurekonzentration. Das bedeutet; Die verdünnte Säurelösung hat im Vergleich zum Säuregehalt mehr Wasser. Die verdünnte Säure kann entweder eine schwache Säure oder eine starke Säure sein. Der Begriff „verdünnt“ beschreibt nur die Konzentration der Säure. Das Gegenteil von verdünnter Säure ist konzentrierte Säure.

Abbildung 02: Konzentrierte HCL -Säure
Darüber hinaus können wir eine Säure verdünnen, indem wir mehr Wasser hinzufügen. Das Hinzufügen von Wasser zu einer konzentrierten Säure ist jedoch gefährlich. Daher besteht die sichere Methode darin, Wasser Säure hinzuzufügen. Das Verdünnen von Säuren ist sehr wichtig, da die Verwendung hochkonzentrierter Säuren schwere Verbrennungen verursachen kann, wenn sie die Haut berührt.
Was ist der Unterschied zwischen schwacher Säure und verdünnter Säure?
Schwaches Säure wird in die Klassifizierung von Säuren nach Säurestärke eingesetzt, während verdünnte Säure unter die Kategorie der Säurekonzentration gerät. Der Schlüsselunterschied zwischen schwacher Säure und verdünnter Säure besteht darin, dass die schwache Säure eine Verbindung ist, die sich teilweise in Wasser löst, während die verdünnte Säure eine Lösung ist, die mehr Wasser als Säure enthält. Die Verdünnung von Säure beeinflusst jedoch nicht die Reaktivität der Säure. Das heißt, eine starke Säure wird bei Verdünnung nicht zu einer schwachen Säure. Aber schwache Säuren sind von Natur aus weniger reaktiv.
Die folgende Infografik fasst den Unterschied zwischen schwacher Säure und verdünnter Säure zusammen.

Zusammenfassung -schwache Säure gegen verdünnte Säure
Schwaches Säure wird nach Säurestärke klassifiziert, und die verdünnte Säure wird in die Kategorie der Säurekonzentration geraten. Der Schlüsselunterschied zwischen schwacher Säure und verdünnter Säure besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Schwache Säure -Definition und Beispiele in der Chemie.Denkweise Mai. 5, 2019, Commons Wikimedia.
Bild mit freundlicher Genehmigung:
1. "Schwache Säurespeziation" durch p. Gans, eigene Zeichnung, Uploader war Petergans bei en.Wikipedia - übertragen von en.Wikipedia nach Commons von Leaw (Public Domain) über Commons Wikimedia
2. "Salzsäure 05" (Public Domain) über Commons Wikimedia


