Was ist der Unterschied zwischen Elektrolyt und Elektrolyse
Der Schlüsselunterschied zwischen Elektrolyt und Elektrolyse ist, dass Elektrolyt eine Substanz ist, die Ionen produzieren kann, während eine Elektrolyse ein Prozess ist, bei dem ein elektrischer Strom verwendet wird, um eine chemische Reaktion voranzutreiben.
Wir verwenden hauptsächlich die Begriffe Elektrolyt und Elektrolyse in der Elektrochemie, bei denen wir die Beziehung zwischen Strom und Chemie untersuchen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein Elektrolyt
3. Was ist eine Elektrolyse
4. Elektrolyt gegen Elektrolyse in tabellarischer Form
5. Zusammenfassung - Elektrolyt gegen Elektrolyse
Was ist ein Elektrolyt?
Ein Elektrolyt ist eine Substanz, die Ionen produzieren kann. Elektrolyte liefern Ionen, wenn sie sich im geschmolzenen Stadium befinden oder wenn sie in einem Lösungsmittel gelöst werden (Wasser). Diese Ionen machen die Elektrolyte in der Lage, Elektrizität zu leisten. Es gibt jedoch auch einige Festkörperelektrolyte. Darüber hinaus produzieren einige Gase wie Kohlendioxid Ionen (Wasserstoff- und Bicarbonationen), wenn sie sich in Wasser auflösen.
Wir können Elektrolyte in zwei verschiedene Gruppen kategorisieren: starke Elektrolyte und schwache Elektrolyte. Unter ihnen produzieren starke Elektrolyte leicht Ionen, wenn sie löslich sind. Zum Beispiel sind ionische Verbindungen starke Elektrolyte. Geschmolzenes Natriumchlorid oder wässrige NaCl-Lösungen unterliegen vollständiger Dissoziation (in Na+ und Klassen); Daher sind sie gute Stromleiter. Starke Säuren und Basen sind auch gute Elektrolyte. Andererseits produzieren schwache Elektrolyte nur wenige Ionen, wenn sie in Wasser löslich sind. Darüber hinaus sind schwache Säuren wie Essigsäure und schwache Basen schwache Elektrolyte.

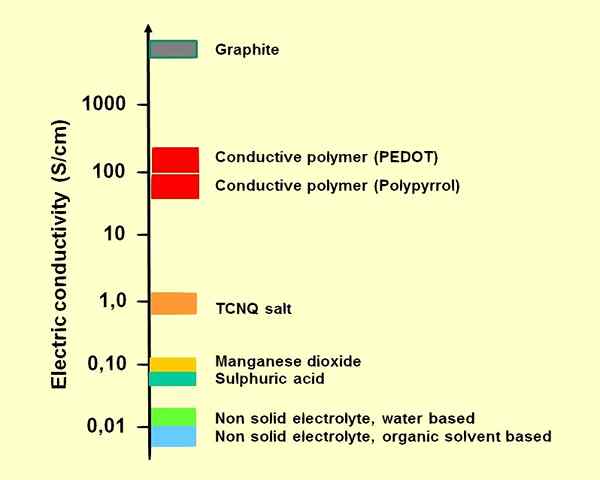
Abbildung 01: Leitfähigkeiten einiger Elektrolyte für elektrolytische Kondensatoren
Elektrolyte treten auch im Körper auf. Wir brauchen diese Elektrolyte, um das ionische Gleichgewicht in Zellen und Blutflüssigkeiten in einem gesunden Körper aufrechtzuerhalten. Elektrolytbilanz ist sehr wichtig, um den osmotischen Gleichgewicht und den Blutdruck im Körper aufrechtzuerhalten. Na+, K+und Ca2+sind wichtig für die Übertragung von Nervenimpulsen und Muskelkontraktionen.
Was ist Elektrolyse?
Elektrolyse ist der Prozess der Verwendung eines direkten elektrischen Stroms, um eine nicht-spontane chemische Reaktion voranzutreiben. Die Elektrolyse kann unter Verwendung einer Elektrolytzelle erfolgen. Diese Technik ist sehr wichtig, um eine Verbindung in ihre Ionen oder anderen Komponenten zu trennen.
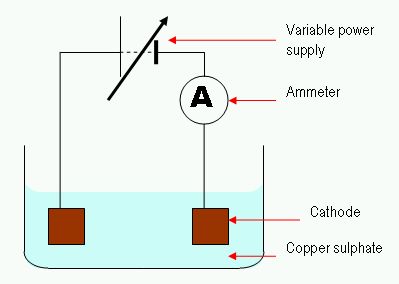
Abbildung 02: Der Prozess der einfachen Elektrolyse
Bei der Elektrolyse führt ein elektrischer Strom eine Lösung für die Mobilität von Ionen in dieser Lösung durch. Typischerweise besteht eine Elektrolytzelle aus zwei Elektroden, die in dieselbe Lösung eingetaucht sind. Wir nennen diese Lösung den Elektrolyten. Ein wichtiges Merkmal bei der Regulierung der Elektrolytzelle ist „über das Potential.„Wir müssen eine höhere Spannung liefern, um eine nicht spontane Reaktion durchzuführen. Hier kann auch eine inerte Elektrode verwendet werden, um die Oberfläche für die auftretende Reaktion bereitzustellen.
Es gibt viele nützliche Anwendungen der Elektrolyse. Eine gemeinsame Anwendung ist die Elektrolyse von Wasser. Hier ist Wasser der Elektrolyt. Dann erfolgt die Reaktion des Abbaues von Wassermolekülen in Wasserstoff- und Sauerstoffgase unter Verwendung des elektrischen Stroms, der durch den Elektrolyten geleitet wird.
Was ist der Unterschied zwischen Elektrolyt und Elektrolyse?
Der Hauptunterschied zwischen Elektrolyt und Elektrolyse besteht darin. Mit anderen Worten, in einem Elektrolyten erzeugt die geschmolzene oder gelöste Substanz Ionen, die sich im flüssigen Zustand oder in einer wässrigen Lösung bewegen können, während in der Elektrolyse die Zersetzung eines Elektrolyten durch einen elektrischen Strom auftritt. Elektrolyt und Elektrolyse hängen auf unterschiedliche Weise miteinander zusammen. Zum Beispiel kann eine Elektrolyse in Gegenwart eines Elektrolyten auftreten.
Zusammenfassung -Elektrolyt gegen Elektrolyse
Daher besteht der Hauptunterschied zwischen Elektrolyt und Elektrolyse darin, dass Elektrolyt ein Substanz ist, der Ionen produzieren kann. Mit anderen Worten, Elektrolyte sind Substanzen, während die Elektrolyse ein Prozess ist.
Referenz:
1. Helmenstine, Anne Marie. „Beispiele für Chemie: Starke und schwache Elektrolyte.”Thoughtco, August. 6, 2019.
Bild mit freundlicher Genehmigung:
1. "Elektrolyteselektrische Leitfähigkeit" durch ELCAP - eigene Arbeit (CC0) über Commons Wikimedia
2. "Elektrolyse Kupfersulfat" von Theresa Knott bei English Wikibooks. - Übertragen von en.Wikibooks zu Commons. (CC BY-SA 3.0) über Commons Wikimedia


