Was ist der Unterschied zwischen Ethylnitrit und Nitroethan
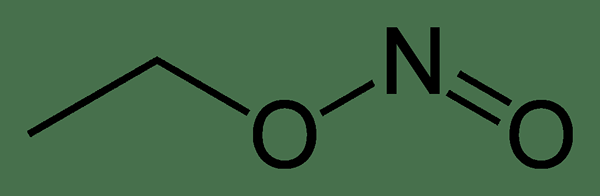
Der Schlüsselunterschied zwischen Ethylnitrit und Nitroethan ist, dass in Ethylnitrit ein Sauerstoffatom an ein Kohlenstoffatom gebunden ist und das andere Sauerstoffatom an ein Stickstoffatom gebunden ist, während in Nitroethan beide Sauerstoffatome an das Stickstoffatom gebunden werden.
Ethylnitrit und Nitroethan haben die gleiche chemische Formel: C2H5NEIN2. Sie sind funktionelle Isomere. Es gibt jedoch mehrere Unterschiede zwischen Ethylnitrit und Nitroethan.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ethylnitrit?
3. Was ist Nitroethan
4. Ethylnitrit gegen Nitroethan in tabellarischer Form
5. Zusammenfassung - Ethylnitrit gegen Nitroethan
Was ist Ethylnitrit??
Ethylnitrit ist eine Art Alkylnitrit mit der chemischen Formel C2H5NEIN2. Es kann aus Ethanol vorbereitet werden. Die Molmasse dieser Verbindung beträgt 75.067 g/mol. Es ist in Wasser schlecht löslich und sein Siedepunkt beträgt 17 Celsius -Grad.

Abbildung 01: Die chemische Struktur von Ethylnitrit
Wir können Ethylnitrit als Reagenz mit Butanon verwenden, um Dimethylglyoxim als Endprodukt zu ergeben. Diese Verbindung ist die Hauptzutat in einem traditionellen Mittel mit Ethanolbasis (gegen Erkältungen und Husten) namens Witdulsies, das einen südafrikanischen Ursprung hat, und es ist ein Mittel gegen Kälte und Grippe. In Südafrika wird es sogar in Apotheken verkauft. Es wurde jedoch verboten, in den USA (in den USA) seit 1980 als süßer Nitrit, süßer Geist oder Nitrit als süßer Nitrit, süßer Geist oder Nitrit verkauft zu werden. Dies liegt daran, dass es mit tödlicher Methämoglobinämie verbunden ist.
Was ist Nitroethan?
Nitroethan ist eine organische Verbindung mit der chemischen Formel C2H5NEIN2, Das ähnelt in vielerlei Hinsicht Nitromethan. Die Molmasse dieser Verbindung beträgt 75.067 g/mol. Nitroethan tritt bei den Standardtemperatur- und Druckbedingungen als ölige Flüssigkeit auf. Pure Nitroethan ist jedoch farblos und hat einen fruchtigen Geruch. Es ist leicht wasserlöslich und hat einen sehr niedrigen Schmelzpunkt (-90 Grad Celsius) und einen hohen Siedepunkt (112 Grad Celsius).
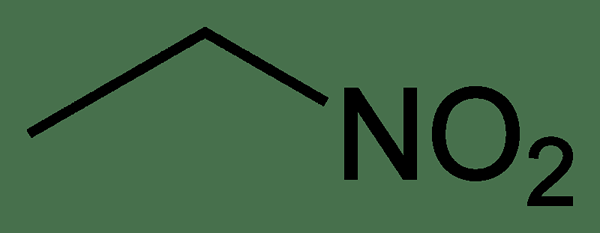
Abbildung 02: Die chemische Struktur von Nitroethan
Bei der Betrachtung der Herstellung von Nitroethan können wir es industriell produzieren, indem wir Propan mit Salpetersäure bei etwa 350 bis 450 Grad Celsius behandeln. Dies ist eine exotherme Reaktion. Es gibt 4 wichtige Nitroalkane: Nitromethan, Nitroethan, 1-Nitropropan und 2-Nitropropan. Darüber hinaus umfasst diese Reaktion freie Radikale, einschließlich des radikalen CH3CH2CH2Ö. Diese radikale Formen bildet sich durch Hämolyse des entsprechenden Nitritester. Dies ist ein Alkoxyradikal, das für C-C-Fragmentierungsreaktionen anfällig ist. Dies erklärt die Bildung der Mischung von Produkten.
Es gibt viele wichtige Verwendungen von Nitroethan, einschließlich der Umwandlung in andere Produkte während der Henry -Reaktion, Kondensation, um Oxazolin, als Brennstoffzusatz und als Vorläufer für Raketentreiber usw.
Was ist der Unterschied zwischen Ethylnitrit und Nitroethan?
Der Schlüsselunterschied zwischen Ethylnitrit und Nitroethan besteht darin, dass in Ethylnitrit ein Sauerstoffatom an ein Kohlenstoffatom gebunden ist. Darüber hinaus erscheint Ethylnitrit als klarer farblos bis gelbe Flüssigkeit, während Nitroethan eine ölige Flüssigkeit ist.
Die folgende Infografik zeigt die Unterschiede zwischen Ethylnitrit und Nitroethan in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -Ethylnitrit gegen Nitroethan
Ethylnitrit und Nitroethan sind zwei chemische Verbindungen mit derselben chemischen Formel. Der Hauptunterschied zwischen Ethylnitrit und Nitroethan ist jedoch ihre chemische Struktur; Ethylnitrit hat ein Sauerstoffatom, das an ein Kohlenstoffatom und ein Sauerstoffatom an einem Stickstoffatom gebunden ist, aber Nitroethan hat beide Sauerstoffatome mit einem Stickstoffatom gebunden.
Referenz:
1. „Ethylnitrit.” Nationales Zentrum für Biotechnologie Information. Pubchem Compound -Datenbank, U.S. Nationalbibliothek für Medizin.
Bild mit freundlicher Genehmigung:
1. "Ethyl-nitrit-2D-Skelettal" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Nitroethane-2D-Skelettal" von Benjah-BMM27-eigene Arbeit (Public Domain) über Commons Wikimedia


