Was ist der Unterschied zwischen der allgemeinen und spezifischen Katalyse der Säurebasis
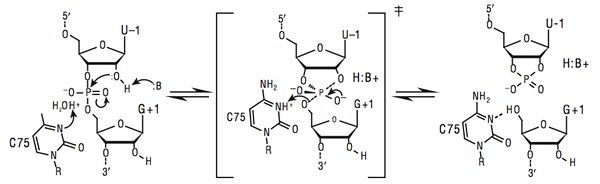
Der Schlüsselunterschied zwischen allgemeiner und spezifischer Säurebasenkatalyse ist, dass allgemeine Säure-Base-Katalyse bei konstantem pH-Wert, jedoch unterschiedliche Pufferkonzentrationen, auftritt, während eine spezifische Säure-Basen-Katalyse nicht von der Konzentration des Puffer abhängt und vom Hydroniumionengehalt abhängt.
Die Katalyse kann als ein Prozess beschrieben werden, bei dem die Geschwindigkeit und das Ergebnis der Reaktion durch das Vorhandensein einer Substanz beeinflusst werden können, die während der Reaktion nicht konsumiert wird. Anschließend wird diese Substanz aus dem Reaktionsgemisch entfernt. Es gibt zwei Arten von Säure-Base-Katalyse, die als allgemeine Katalyse und spezifische Katalyse bezeichnet werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die allgemeine Katalyse der Säurebasis
3. Was ist eine spezifische Katalyse der Säurebasis
4. Allgemeine gegen spezifische Säure -Basen -Katalyse in tabellarischer Form
5. Zusammenfassung -allgemeine gegen spezifische Säurebasenkatalyse
Was ist die allgemeine Katalyse der Säurebasis?
Allgemeine Säure-Base-Katalyse ist eine Art der Katalyse, die auftritt, wenn saure oder basischen Reste am aktiven Zentrum nützlich sind, um Protonentransfers in der Reaktion zu erleichtern. Diese Art der Katalyse ist wichtig für die Spezifität und die Ratenverstärkung. Die allgemeine Säure oder Base bezieht sich auf einen Aminosäurerest in einer Glykosidhydrolase oder auf ein verwandt. Dieser Mechanismus ist entweder ein beibehaltener oder invertierender Mechanismus.

Was ist eine spezifische Katalyse der Säurebasis?
Spezifische Säure-Base-Katalyse ist ein Prozess, bei dem die Reaktionsgeschwindigkeit von der spezifischen Base und nicht von den anderen Basen in der Lösung abhängt. Mit anderen Worten, die Katalyse erfolgt durch ein Hydronium oder Hydroxidion und kann nur durch den pH -Wert bestimmt werden, nicht durch die Pufferkonzentration.
Beispielsweise ist die Hydrolyse von Ethylacetat eine spezifische Säure-Base-Reaktion. Dies ist eine äußerst langsame Reaktion bei neutralem pH -Wert, da sowohl Nucleophile als auch Elektrophile nicht reaktiv sind. Darüber hinaus kann die Reaktionsgeschwindigkeit beschleunigt werden, oder die Reaktivität des Nucleophils oder des Elektrophils kann verstärkt werden. Da der Anstieg des pH -Werts die Konzentration von Hydroxidionen erhöhen kann. Andererseits kann eine abnehmende pH -pH.
Was ist der Unterschied zwischen der allgemeinen und spezifischen Katalyse der Säurebasis?
Der Schlüsselunterschied zwischen allgemeiner und spezifischer Säurebasenkatalyse besteht darin, dass die allgemeine Säure-Base-Katalyse bei konstanter pH-Wert, jedoch unterschiedliche Pufferkonzentrationen, auftritt. Darüber hinaus wirkt das Lösungsmittel in der allgemeinen Säurebasiskatalyse nicht als Säure oder Base, während in der spezifischen Katalyse der Säurebasis das Lösungsmittel als Säure oder Base wirkt.
Die folgende Tabelle fasst den Unterschied zwischen der allgemeinen und spezifischen Säurebasenkatalyse zusammen.
Zusammenfassung -allgemeine gegen spezifische Säurebasenkatalyse
Allgemeine Säure-Base-Katalyse ist eine Art der Katalyse, die auftritt, wenn saure oder basischen Reste am aktiven Zentrum nützlich sind, um Protonentransfers in der Reaktion zu erleichtern. Spezifische Säure-Base-Katalyse ist ein Prozess, bei dem die Reaktionsgeschwindigkeit von der spezifischen Base und nicht von den anderen Basen in der Lösung abhängt. Der Schlüsselunterschied zwischen allgemeiner und spezifischer Säurebasenkatalyse besteht darin, dass die allgemeine Säure-Base-Katalyse bei konstanter pH-Wert, jedoch unterschiedliche Pufferkonzentrationen, auftritt.
Referenz:
1. „A1. Allgemeine Säure- und Basenkatalyse.” Chemie -Libretexten, Libretexten, 11. August. 2020.
Bild mit freundlicher Genehmigung:
1. "Säurebasenkatalyse" von Noxwei - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


