Was ist der Unterschied zwischen isentropem und polytropem Prozess
Der Schlüsselunterschied zwischen isentropem und polytropem Prozess Ist dieser isentropische Prozess immer eine geringere Effizienz, während der polytropische Prozess immer eine höhere Effizienz zeigt.
Der isentropische Prozess ist ein thermodynamischer Prozess, bei dem sowohl adiabatische als auch reversible Nature beobachtet werden können. Polytropischer Prozess hingegen ist ein reversibler Prozess auf einem offenen oder geschlossenen System von Gas oder Dampf, bei dem sowohl Wärme- als auch Arbeitsübertragung beteiligt sind, so dass während des gesamten Prozesses eine bestimmte Kombination von Eigenschaften aufrechterhalten wird.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein isentropischer Prozess
3. Was ist ein polytropischer Prozess
4. Isentropischer vs polytropischer Prozess in tabellarischer Form
5. Zusammenfassung -isentropischer vs polytropischer Prozess
Was ist ein isentropischer Prozess?
Ein isentropischer Prozess ist ein thermodynamischer Prozess, bei dem sowohl adiabatische als auch reversible Naturen beobachtet werden können. In diesem Prozess sind die Arbeitstransfers des Systems tendenziell reibungslos und treten ohne Wärme oder Materie auf. Dies ist ein idealisierter Prozess, der für das Engineering als Modell zum Vergleich mit realen Prozessen nützlich ist. Wir können es als einen reversiblen Prozess idealisieren, der in der Realität nicht auftritt. Dies liegt daran. Wir können diesen Begriff jedoch auf andere Weise interpretieren, ich.e., Ein System, das seine Entropie unverändert hat.

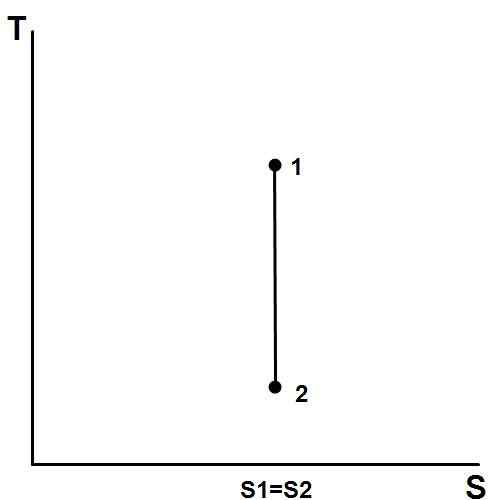
Abbildung 01: in einem T-S (Entropie vs. Temperatur) Diagramm eines isentropischen Prozesses. Hier bleibt die Entropie konstant
Spontane Prozesse erhöhen die Entropie des Universums. In diesem Fall kann entweder die Systementropie oder die umgebende Entropie zunehmen. Ein isentropischer Prozess tritt auf, wenn die Systementropie konstant bleibt.
Ein reversibler adiabatischer Prozess ist ein Beispiel für einen isentropischen Prozess. Darüber hinaus sind die konstanten Parameter in einem isentropischen Prozess Entropie, Gleichgewicht und Wärmeenergie.
Was ist ein polytropischer Prozess?
Ein polytropischer Prozess kann als reversibler Prozess auf einem offenen oder geschlossenen System von Gas oder Dampf beschrieben werden, bei dem sowohl Wärme-. Es tritt bei einer Wärmeübertragung auf. Die Wärmeübertragung erfolgt jedoch in diesem Prozess reversibel. Wenn ein Gas dieser Art der Wärmeübertragung durchläuft, gilt die folgende Gleichung für einen polytropischen Prozess.
Pvn = konstant
Hier ist P der Druck, V ist das Volumen und N ist eine Konstante. Um PV konstant im polytropischen Gaserweiterung/-komprimierungsprozess konstant zu halten, findet zwischen dem System und seiner Umgebung statt. Daher ist polytropic ein nicht adiabatischer Prozess.
Was ist der Unterschied zwischen isentropem und polytropem Prozess?
Ein isentropischer Prozess ist ein thermodynamischer Prozess, bei dem sowohl adiabatische als auch reversible Naturen beobachtet werden können. Ein polytropischer Prozess ist ein reversibler Prozess für ein offenes oder geschlossenes Gas- oder Dampfsystem, das sowohl Wärme- als auch Arbeitsübertragung umfasst. Der Hauptunterschied zwischen isentropem und polytropem Prozess besteht darin, dass ein isentropischer Prozess immer eine geringere Effizienz zeigt, während ein polytropischer Prozess immer eine höhere Effizienz zeigt.
Die folgende Infografik zeigt die Unterschiede zwischen isentropem und polytropem Prozess in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -isentropischer vs polytropischer Prozess
Isentropische Prozesse und polytropische Prozesse sind in der physikalischen Chemie wichtig. Ein isentropischer Prozess ist ein thermodynamischer Prozess, bei dem sowohl adiabatische als auch reversible Naturen beobachtet werden können. Ein polytropischer Prozess ist ein reversibler Prozess für ein offenes oder geschlossenes Gas- oder Dampfsystem, das sowohl Wärme- als auch Arbeitsübertragung umfasst. Der Hauptunterschied zwischen isentropem und polytropem Prozess besteht darin, dass ein isentropischer Prozess immer eine geringere Effizienz als ein polytropischer Prozess aufweist.
Referenz:
1. Kirkby, n.F. „Polytropischer Prozess.” Thermopedia, Begel House Inc.
Bild mit freundlicher Genehmigung:
1. "Isentropic" von Tyler.Neysmith - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


