Was ist der Unterschied zwischen Methylchlorid und Methylenchlorid

Der Schlüsselunterschied zwischen Methylchlorid und Methylenchlorid ist, dass Methylchlorid bei Raumtemperatur als farbloses, geruchloses Gas auftritt, während Methylenchlorid als farblose, flüchtige Flüssigkeit bei Raumtemperatur auftritt.
Methylchlorid und Methylenchlorid sind industriell wichtige organische Verbindungen. Methylchlorid oder Chlormethan ist eine organische Verbindung mit der chemischen Formel CH3CL, während Methylenchlorid oder Dichlormethan eine organische Verbindung mit der chemischen Formel CH2CL2 ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Methylchlorid (Chlormethan)
3. Was ist Methylenchlorid (Dichlormethan)
4. Methylchlorid gegen Methylenchlorid in tabellischer Form
5. Zusammenfassung -Methylchlorid gegen Methylenchlorid
Was ist Methylchlorid (oder Chlormethan)?
Methylchlorid oder Chlormethan ist eine organische Verbindung mit der chemischen Formel CH3CL. Es ist auch als Kältemittel 40, R-40 oder HCC 40 bekannt. Es ist ein Haloalkan, das farblos, geruchlos, brennbar ist und in einem Gaszustand bei Raumtemperatur auftritt. Diese Verbindung ist eine entscheidende Substanz in der industriellen Chemie, tritt jedoch selten bei Konsumgütern auf. Methylchlorid wurde erstmals 1835 von einem französischen Chemiker durch Kochen eines Gemisches aus Methanol, Schwefelsäure und Natriumchlorid produziert. Heute wird es kommerziell durch Behandlung von Methanol zusammen mit Salzsäure oder Wasserstoffchlorid produziert.
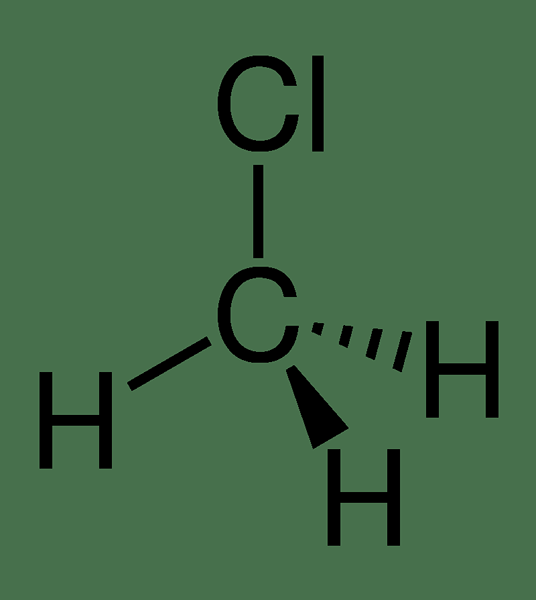
Abbildung 01: Die chemische Struktur von Methylchlorid
Diese Substanz ist eine reichlich vorhandene Organohalogen -Verbindung, die in der Atmosphäre entweder natürlich oder anthropogen ist. Das Gas hat einen schwachen, süßen Geruch. Einige marine Mikroorganismen können Methylchlorid produzieren. Darüber hinaus können Salzbreipflanzen auch diese Substanz produzieren.
Methylchloridverbindung hat eine tetragonale Geometrie. Seine molekulare Form ist ein Tetraeder. Darüber hinaus wird es als krebserzeugte Verbindung angesehen.
Was ist Methylenchlorid (oder Dichlormethan)?
Methylenchlorid oder Dichlormethan ist eine organische Verbindung mit der chemischen Formel CH2CL2. Es ist eine Organochlorverbindung, und wir können sie als DCM bezeichnen. Diese Verbindung tritt als flüchtige, farblose Flüssigkeit auf, die aus einem chloroformenähnlichen süßen Geruch besteht. Dichlormethan ist hauptsächlich als Lösungsmittel nützlich. Diese Flüssigkeit ist nicht mit Wasser mischbar, obwohl es sich um eine polare Verbindung handelt. Es kann sich jedoch mit vielen anderen organischen Lösungsmitteln vermischen.

Abbildung 02: Methylenchlorid
Es gibt einige natürliche Quellen von Dichlormethan, darunter ozeanische Quellen, Makroalgen, Feuchtgebiete und Vulkane. Wir können jedoch beobachten, dass der größte Dichlormethan in der Umwelt auf industrielle Emissionen zurückzuführen ist. Wir können Dichlormethan durch die Behandlung von Chlormethan oder Methan mit Chlorgas bei hohen Temperaturen produzieren.
Was ist der Unterschied zwischen Methylchlorid und Methylenchlorid?
Methylchlorid und Methylenchlorid sind industriell wichtige organische Verbindungen. Methylchlorid oder Chlormethan ist eine organische Verbindung mit der chemischen Formel CH3CL. Methylenchlorid oder Dichlormethan ist eine organische Verbindung mit der chemischen Formel CH2CL2. Der Schlüsselunterschied zwischen Methylchlorid und Methylenchlorid besteht darin.
Die folgende Infografik zeigt die Unterschiede zwischen Methylchlorid und Methylenchlorid in tabellarischer Form für Seite für Seitenvergleich.
Zusammenfassung -Methylchlorid gegen Methylenchlorid
Methylchlorid und Methylenchlorid sind industriell wichtige organische Verbindungen. Der Schlüsselunterschied zwischen Methylchlorid und Methylenchlorid besteht darin. Methylchlorid ist als Lokalanästhetikum wichtig, ein chemisches Intermediat bei der Produktion von Silikonpolymer, bei der Herstellung von Arzneimitteln usw., Während Methylenchlorid für Lackierungen, pharmazeutische Herstellung, Lackentfernerproduktion, Metallreinigung und Entfettung wichtig ist.
Referenz:
1. "Methylenchlorid - Übersicht" Arbeitsschutz und Gesundheitsministerium, US -amerikanische Logo -Ministerium.
Bild mit freundlicher Genehmigung:
1. "NATTA -Projektion von Chlormethan" von Chem SIM 2001 - eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Probe von Dichlormethan" von Lhchem - eigener Arbeit (CC BY -SA 3.0) über Commons Wikimedia


