Unterschied zwischen Säure und Alkalin
Der Schlüsselunterschied Zwischen Säure und Alkalin ist das Der pH -Wert von Säuren liegt unter dem pH 7, während der pH -Wert von Alkalin über pH 7 liegt.
Säuren und Basen sind zwei wichtige Konzepte in der Chemie. Sie haben widersprüchliche Eigenschaften. Alkalin ist eine Untergruppe von Basen. Somit hat es alle grundlegenden Eigenschaften. Außerdem gibt es verschiedene Methoden, um zwischen Säure und Alkali zu unterscheiden, die wir unten diskutieren werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Säure
3. Was ist alkalisch
4. Seite an Seite Vergleich - Säure gegen alkalin in tabellarischer Form
5. Zusammenfassung
Was ist Säure?
Es gibt mehrere Definitionen für Säuren verschiedener Wissenschaftler. Arrhenius definiert eine Säure als eine Substanz, die h spendet3Ö+ Ionen in der Lösung. Während Bronsted-Lowry eine Säure als eine Substanz definiert, die einen Proton spenden kann. Die Definition von Lewis -Säure ist jedoch weitaus häufiger als die oben genannten zwei. Danach ist jeder Elektronenpaarakzeptor eine Säure. Nach der Definition von Arrhenius oder Bronsted-Lowry sollte eine Verbindung, um sie als Säure zu benennen, Wasserstoff und die Fähigkeit haben, sie als Proton zu spenden. Laut Lewis gibt es jedoch Moleküle, die keinen Wasserstoff besitzen, aber als Säure wirken können. Zum Beispiel BCL3 ist eine Lewis -Säure, weil sie ein Elektronenpaar akzeptieren kann. Alkohol ist eine Bronsted-Lowry-Säure, weil er ein Proton spenden kann, aber laut Lewis ist es eine Basis.

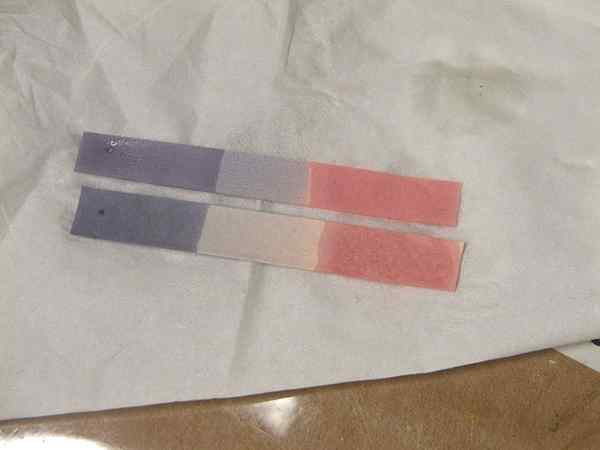
Abbildung 01: Lackmusfarbe für Säuren und Basen
Unabhängig von den oben genannten Definitionen identifizieren wir normalerweise eine Säure als Protonenspender. Säuren haben einen sauren Geschmack. Limettensaft, Essig sind zwei Säuren, auf die wir in unseren Häusern stoßen. Sie reagieren mit Basen, die Wasser produzieren, und reagieren auch mit Metallen, um H zu bilden2, Erhöhen Sie daher die Metallkorrosionsrate. Wir können Säuren in zwei Klassen kategorisieren, abhängig von ihrer Fähigkeit, Protonen zu dissoziieren und zu produzieren. Sie sind starke Säuren und schwache Säuren.
Starke Säuren und schwache Säuren
Starke Säuren wie HCl, Hno3 kann in einer Lösung vollständig ionisieren, um Protonen zu verleihen. Schwache Säuren wie ch3COOH kann teilweise dissoziieren, um weniger Mengen an Protonen zu geben. Ka ist die Säure -Dissoziationskonstante. Es gibt einen Hinweis auf die Fähigkeit, ein Proton einer schwachen Säure zu verlieren. Um zu überprüfen, ob eine Substanz eine Säure ist oder nicht, können wir mehrere Indikatoren wie Lackmuspapier oder pH -Papier verwenden. In der pH-Skala von 1-6 Säuren sind dargestellt (unterhalb von pH 7). Eine Säure mit pH 1 ist sehr stark und mit zunehmender pH -Wert nimmt der Säuregehalt ab. Darüber hinaus werden Säuren blau Lackmus zu rot.
Was ist alkalisch?
Alkalin hat einen pH über 7. Daher liegt der pH -Wert einer alkalischen Substanz über pH 7. Elemente der Gruppe 1 und Gruppe 2, die wir als alkalische Metalle und alkalische Erdmetalle nennen, sind gemeinsame alkalische Substanzen, und sie geben alkalische Lösungen an, wenn wir sie in Wasser auflösen. Natriumhydroxid, Kaliumhydroxid, Magnesiumhydroxid und Calciumcarbonat sind einige der Beispiele für diese alkalischen Substanzen.
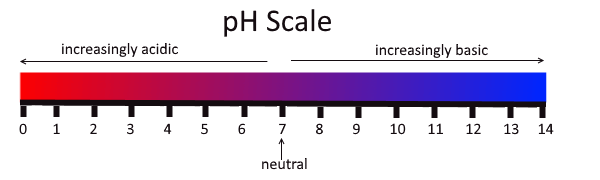
Abbildung 02: Säuren und Basen in der pH -Skala
Arrhenius definiert die Basen als die Substanzen, die OH erzeugen- in Lösungen. Über Molekülen bilden OH- Wenn wir sie in Wasser auflösen, wirken wir daher als Basen. Alkalische Lösungen reagieren leicht mit Säuren, die Wasser- und Salzmoleküle produzieren. Sie zeigen einen pH -Wert von mehr als 7 und machen den roten Lackmus in Blau. Es gibt andere Basen mit Ausnahme von alkalischen Basen wie NH3. Sie haben auch die gleichen grundlegenden Eigenschaften.
Was ist der Unterschied zwischen Säure und Alkalin?
Säuren und Alkalin sind zwei Formen von Verbindungen, die wir nach dem pH -Wert kategorisieren. Daher besteht der Schlüsselunterschied zwischen Säure und Alkalin darin, dass der pH -Wert von Säuren unter dem pH 7 liegt, während der pH -Wert von Alkalin über pH 7 liegt. Darüber hinaus können Säuren ionisieren, um Protonen oder H zu bilden+ Ionen, während alkalische Verbindungen ionisieren können, um Hydroxidionen zu bilden. Wenn wir den Geschmack und die Textur dieser beiden Verbindungen berücksichtigen, können wir einen weiteren Unterschied zwischen Säure und alkalischen Verbindungen erhalten. Das heißt, Säuren schmecken sauer und haben ein klebriges Gefühl, während Alkaline bitter schmeckt und ein rutschiges Gefühl hat.
Die folgende Infografik fasst den Unterschied zwischen Säure und Alkalin in tabellarischer Form zusammen.
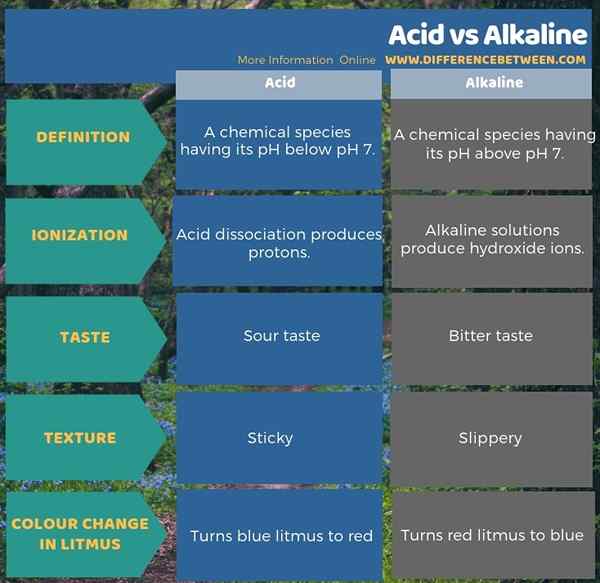
Zusammenfassung -Säure gegen alkalisch
Säuren und Alkalinen haben aufgrund ihres unterschiedlichen chemischen Verhaltens entgegengesetzte chemische und physikalische Eigenschaften. Der Schlüsselunterschied zwischen Säure und Alkalin besteht darin, dass der pH -Wert von Säuren unter dem pH 7 liegt, während der pH -Wert von Alkalin über pH 7 liegt.
Referenz:
1. Britannica, die Herausgeber von Encyclopaedia. "Säure.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 27. Dezember. 2017. Hier verfügbar
2. „Alkaline | Definition von Alkalin auf Englisch durch Oxford -Wörterbücher.”Oxford Wörterbücher | Englisch, Oxford Wörterbücher. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Lackmus Paper” von Chemicalinterest - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia
2.”PH -Skala” von Christinelmiller - eigenes Werk (CC BY -SA 4).0) über Commons Wikimedia


