Unterschied zwischen aktiviertem Komplex und Übergangszustand
Aktivierter Komplex gegen Übergangszustand | Übergangskomplex gegenüber Aktivierungskomplex
Wenn ein oder mehrere Reaktanten in Produkte umwandeln, können sie unterschiedliche Modifikationen und Energieveränderungen durchlaufen. Die chemischen Bindungen in den Reaktanten brechen, und es bilden sich neue Bindungen, um Produkte zu erzeugen, die sich völlig von den Reaktanten unterscheiden. Diese chemische Modifikation wird als chemische Reaktionen bezeichnet. Es gibt zahlreiche Variablen, die die Reaktionen steuern. Damit eine Reaktion stattfinden kann, sollte Energie erforderlich sein. Reaktantmoleküle durchlaufen Veränderungen während der gesamten Reaktion unter der Annahme verschiedener Atomkonfigurationen. Aktivierter Komplex und Übergänge sind zwei Terminologien, die zur Identifizierung dieser Zwischenkomplexe verwendet werden, und die meiste Zeit werden diese beiden Begriffe austauschbar verwendet.
Was ist aktiviert Komplex?
Ein Molekül muss aktiviert werden, bevor es sich reagieren kann. Moleküle haben normalerweise nicht viel Energie mit ihnen, nur gelegentlich sind einige Moleküle in einem Energiezustand, um Reaktionen zu unterziehen. Wenn es zwei Reaktanten gibt, müssen die Reaktanten in der richtigen Ausrichtung miteinander kollidieren. Obwohl Reaktanten sich nur gegenseitig begegnen, führen die meisten Begegnungen nicht zu einer Reaktion. Diese Beobachtungen haben die Idee, eine Energiebarriere für Reaktionen zu haben. Die Reaktanten mit höheren Energiezuständen im Reaktionsgemisch können als aktivierte Komplexe angesehen werden. Nicht alle aktivierten Komplexe können an die Produkte gehen, sie können auf Reaktanten zurückgefallen, wenn sie nicht genug Energie haben.
Was ist der Übergangszustand?
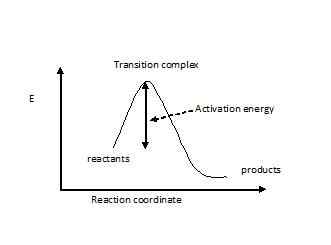
Der Übergangszustand wird an einen angenommen, in dem das reagierende Molekül angespannt oder verzerrt ist oder eine ungünstige elektronische Konfiguration aufweist. Das Molekül muss diesen hochenergieübergreifenden Übergangszustand durchlaufen, bevor die Reaktion auftreten soll. Die Energielücke wird als Aktivierungsenergie bezeichnet. Dies ist die höchste Energiebarriere für eine Reaktion, die stattfinden kann. Wenn die Aktivierung für eine Reaktion zu hoch ist, hat nur ein kleiner Teil von Molekülen genügend Energie, um sie zu überwinden. Daher wird die erwartete Produktkonzentration nicht erhalten. Die atomare Anordnung aller Moleküle in der Reaktion, die die Aktivierungsenergie aufweist, wird als Übergangskomplex bezeichnet. Der Übergangskomplex hat Komponenten mit teilweise kaputten Bindungen und teilweise neue Anleihen. Daher hat es teilweise negative und positive Ladungen. Der Übergangszustand wird mit einem Doppel -Dolch -Zeichen angezeigt (‡). Wenn die Übergangszustandsenergie einer Reaktion gesenkt werden kann, sollte die Reaktion viel schneller sein und benötigt eine geringe Energie, um fortzufahren. Für eine exotherme Reaktion folgt die Energiekurve nach.
 Es ist wichtig, die Strukturen des Übergangszustands zu kennen, insbesondere bei der Gestaltung der Arzneimittel gegen die Enzymhemmung.
Es ist wichtig, die Strukturen des Übergangszustands zu kennen, insbesondere bei der Gestaltung der Arzneimittel gegen die Enzymhemmung.
|
Was ist der Unterschied zwischen aktiviertem Komplex und Übergangszustand? • Der Übergangszustand ist die Atomanordnung mit der höchsten Energie, wenn Reaktanten zu Produkten gehen. Aktivkomplexe sind alle anderen Konfigurationen im Reaktionsweg, die höhere Energie haben als normale Moleküle. • Es besteht die Möglichkeit eines Übergangszustandskomplexes, zu den Produkten zu gehen. Aktivierungskomplexe können jedoch zu Reaktanten zurückgreifen, als zu den Produkten zu gehen.
|


