Unterschied zwischen Ammoniak und Ammonium
Der Schlüsselunterschied Zwischen Ammoniak und Ammonium ist das Ammoniak ist ein ungeladenes polares Molekül, das bei Raumtemperatur als Gas besteht.
Es gibt nur wenige Bilder und sogar bestimmte Gerüche, die unser Geist sofort mit Ammoniak oder Ammonium verbinden. Dazu gehören diejenigen von Düngemitteln, stickstoffhaltigen Abfällen, Seifen und sogar Sprengstoff. Darüber hinaus gehen die meisten Menschen davon aus, dass es keinen Unterschied zwischen Ammoniak und Ammonium gibt. Die hohe Ähnlichkeit zwischen diesen beiden und die Verwendung des Wortes Ammoniak häufiger als allgemeiner Begriff für reine Ammoniak- und Ammoniumverbindungen bringt diese Verwirrung auf.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ammoniak
3. Was ist Ammonium
4. Seite an Seitenvergleich - Ammoniak gegen Ammonium in tabellarischer Form
5. Zusammenfassung
Was ist Ammoniak?
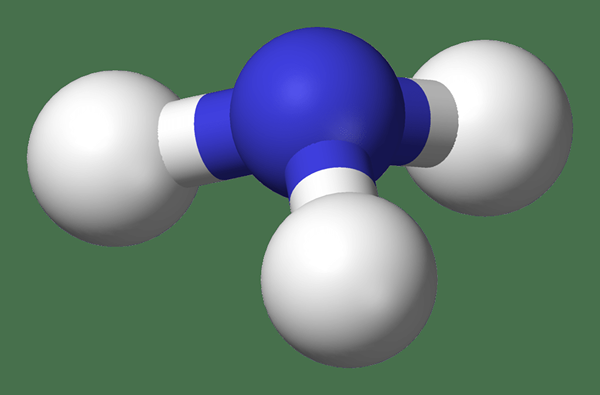
Ammoniak ist eine Verbindung von Stickstoff und Wasserstoff mit der Formel NH3. Es ist ungeladen und ein Molekül für sich; Es existiert als Gas bei Raumtemperatur und atmosphärischem Druck sowie als Flüssigkeit bei sehr niedrigen Temperaturen und hohen Drücken. Wir nennen diese reine Form von Ammoniak wasserfrei (wasserfrei) Ammoniak. Ammoniakgas ist farblos und hat einen scharfen, intensiv irritierenden Geruch. Darüber hinaus ist es giftig.

Abbildung 01: Ammoniakmolekül
Ammoniak ist wie Wasser aufgrund seiner ungleichen Elektronenverteilung polar. Diese Polarität macht es in Wasser löslich. Ein wichtiger Punkt ist zu beachten, dass ein solubilisiertes oder wässriges Ammoniak in Form von Ammoniumhydroxid besteht, das weiter dissoziiert, Ammoniumion und Hydroxidion zu bilden. Diese Dissoziation hängt von der Temperatur und dem pH -Wert der Lösung ab (Dissoziation steigt mit zunehmendem Temperatur und der Abnahme des pH).
Was ist Ammonium?
Das Ammoniumkation ist ein positiv geladenes polyatomisches Ion mit der chemischen Formel NH4+. Dies ist ein Ion, das als freie Ionen in Lösungen oder als ionische Salzverbindung existieren könnte, die eine Gitterstruktur mit einem Anion bildet; Zum Beispiel Ammoniumchlorid.
Daher verwenden wir den Begriff Ammonium im Allgemeinen nicht als Wort für sich; Es geht immer den Worten 'Ion, "Salz" oder dem jeweiligen negativ geladenen Ion voraus. Zum Beispiel muss es Ammoniumion, Ammoniumhydroxid, Ammoniumnitrat, Ammoniumsulfat usw. sein., Und nicht nur Ammonium.
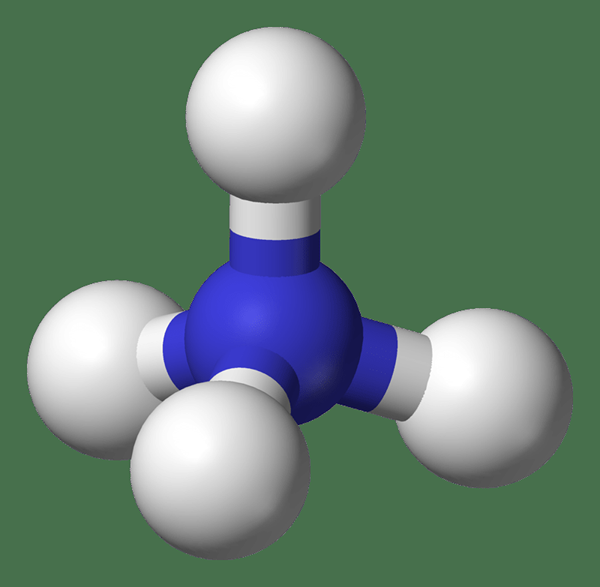
Abbildung 02: Ammoniumionen
Ammoniumionen haben keine charakteristischen Gerüche; Ammoniumsalze in wässriger Lösung mit langsamer Dissoziation geben jedoch Gerüche, die für Ammoniak charakteristisch sind.
Was ist der Unterschied zwischen Ammoniak und Ammonium?
Ammonium ist das Hauptkation, das aus Ammoniak stammt. Der Hauptunterschied zwischen Ammoniak und Ammonium besteht darin, dass Ammoniak ein ungeladenes, aber poliges Molekül ist, das bei Raumtemperatur als Gas besteht. Darüber hinaus hat Ammoniak einen scharfen, intensiv irritierenden Geruch, während Ammoniumion selbst keinen charakteristischen Geruch hat.
Bei der Betrachtung der Toxizität ist Ammoniak giftig, aber freie Ammoniumionen für sich selbst sind nicht toxisch. Die Ammoniumverbindungen können jedoch toxisch sein. Darüber hinaus hat Ammoniak selbst eine Reihe von Eigenschaften, aber die Eigenschaften von Ammoniumverbindungen hängen auch vom zugehörigen Anion ab.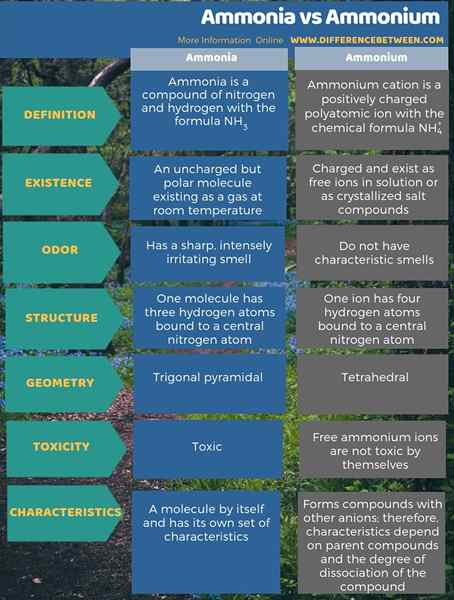
Zusammenfassung -Ammoniak gegen Ammonium
Kurz gesagt, Ammonium ist das Hauptkation, das aus Ammoniak stammt. Der Hauptunterschied zwischen Ammoniak und Ammonium besteht darin, dass Ammoniak ein ungeladenes, aber poliges Molekül ist, das bei Raumtemperatur als Gas besteht.
Referenz:
1. „Prozessschritte der Ammoniakproduktion.”Ammoniak, pp. 65-176., doi: 10.1002/9783527613885.CH04.
Bild mit freundlicher Genehmigung:
1. "Ammoniak-3d-Balls" (Public Domain) über Commons Wikimedia
2. "Ammonium-3d-Balls" (Public Domain) über Commons Wikimedia


