Unterschied zwischen Amphiprotikal und Amphoter
Amphiprotische gegen Amphotere
Da amphiprototisch und amphoter ist ziemlich ähnlich, ist auch der Unterschied zwischen amphipotisch und amphoterisch. Beide Begriffe, amphiprotisch und amphoter, hängen beide mit der Säure-Base-Chemie zusammen. Amphoterische Substanzen verhalten sich als Säure und als Basis. Alle amphiprotischen Substanzen können Protonen spenden und akzeptieren und sowohl Säure- als auch Baseneigenschaften zeigen. Deshalb sind sie auch amphoter. Dieser Artikel beschreibt den Unterschied zwischen amphipotischen Substanzen und amphoterischen Substanzen im Detail. Darüber hinaus gibt es Beispiele und Reaktionen, um ihre Eigenschaften zu zeigen.
Was sind amphiprotische Substanzen?
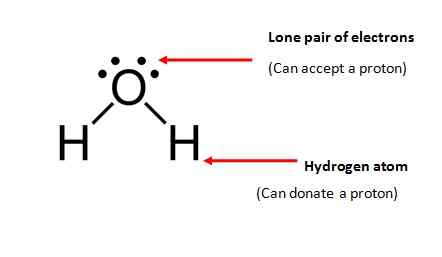
Der Begriff amphiprotische bezieht sich auf die Substanzen, die sowohl ein Proton akzeptieren als auch spenden können. Es kann entweder ionisch oder kovalent sein. Daher sollte eine amphoterische Substanz zwei Haupteigenschaften haben.
- Das Molekül muss mindestens ein Wasserstoffatom enthalten und kann an ein anderes Molekül gespendet werden.
- Das Molekül muss ein einsames Elektronenpaar (Elektronen, die nicht an der chemischen Bindung beteiligt sind) enthalten, um ein Proton zu akzeptieren.
Wasser (h2O) ist am häufigsten amphiprotische Substanzen; Ein Wassermolekül erfüllt beide Anforderungen, die für eine amphipotische Substanz erforderlich sind.

Zusätzlich zu Wasser können die meisten konjugierten Basen von diprotischen Säuren als amphiprotische Substanzen wirken.
Diprotische Säure -Konjugat -Base
H2SO4 HSO4-
H2CO3 HCO3-
H2S hs-
H2Cro3 HCRO3-
Beispiel: Carbonsäure (h2CO3) ist eine schwache diprotische Säure, Bicarbonat (HCO3-) ist seine konjugierte Basis. In wässrigen Lösungen zeigt Bicarbonat zwei Arten von Reaktionen.
(1) Spenden eines Protons an Wasser (als Bronsted - Lowrysäure)
HCO3- (aq) + H2O -> h3Ö+ (aq) + CO32- (aq)
(2) Ein Proton aus Wasser akzeptieren (als Bronsted -Lowry -Basis)
HCO3- (aq) + H2O -> h2CO3 (aq) + OH- (aq)
Daher Bicarbonat (HCO3-) ist eine amphiprotische Art.
Was sind amphotere Substanzen??
Substanzen, die sowohl als Säure als auch als Base wirken können. Diese Definition ist den amphipotischen Substanzen sehr ähnlich. Denn alle amphiprotischen Substanzen zeigen saure Eigenschaften durch Spenden eines Protons und zeigen in ähnlicher Weise grundlegende Eigenschaften, indem sie ein Proton akzeptieren. Daher können alle amphipotischen Substanzen als amphoteres betrachtet werden. Die umgekehrte Aussage ist jedoch nicht immer wahr.
Wir haben drei Theorien für Säuren und Basen:
Theorie Säurebase
Arrhenius h+ Produzent OH- Hersteller
Bronsted-Lowry h+ Spender h+ Akzente
Lewis Elektronspaar Akzeptor -Elektronenpaarspender
Beispiel: Al2o3 ist eine Lewis -Säure und eine Lewis -Basis. Daher handelt es sich um eine amphotere Substanz, da sie keine Protonen enthält (H)+), es ist keine amphiprotische Substanz.
Al2Ö3 als Basis:
Al2Ö3 + 6 HCl-> 2 Alcl3 + 3 h2Ö
Al2Ö3 als Säure:
Al2Ö3 + 2naoh + 3 h2O -> Naal (OH)4
Was ist der Unterschied zwischen amphiprotisch und amphoterisch?
• Eine amphiprotische Substanz verhält sich wie eine Säure und als Basis. Eine amphoterische Substanz kann ein Proton akzeptieren oder spenden (h)+ Ion).
• Alle amphoteren Substanzen sind amphiprotisch, aber alle amphiprotischen Substanzen sind nicht amphoterisch.
• Amphiprotische Arten berücksichtigen die Fähigkeit, ein Proton zu spenden oder zu akzeptieren. Amphotere Spezies betrachten jedoch die Fähigkeit, als Säure und als Basis zu wirken. Die Säure-Base-Eigenschaften hängen von drei Faktoren ab, einschließlich der Fähigkeit, ein Proton zu spenden oder zu akzeptieren.
Wenn eine Substanz ein Elektronenpaar zum Spenden besitzt und die Fähigkeit, ein Elektronenpaar zu akzeptieren.
Wenn eine Substanz die Fähigkeit hat, sowohl H+ Ion als auch OH-Ion zu produzieren, wird sie als amphoter angesehen.
Zusammenfassung:
Amphiprotische gegen Amphotere
Amphoterische und amphiprotische Substanzen hängen mit der Säure-Base-Chemie zusammen. Beide Substanzen zeigen Säure- und Baseneigenschaften. Mit anderen Worten, sie können je nach den anderen Reaktanten als Säure und als Basis reagieren. Amphipotische Substanzen können einen Proton spenden und akzeptieren. Wasser ist das häufigste Beispiel für eine amphiprotische Art. Die meisten konjugierten Basen von diprotischen Säuren ebenfalls amphipotisch. Amphoterische Substanzen können sich als Säure und als Basis verhalten.


