Unterschied zwischen Ionisation und Elektrolyse
Der Schlüsselunterschied zwischen Ionisation und Elektrolyse ist das Ionisation ist die Bildung chemischer Spezies mit elektrischer Ladung, während die Elektrolyse der Prozess der Verwendung eines elektrischen Stroms zur Durchführung einer nicht spontanen chemischen Reaktion ist.
Ionisierung und Elektrolyse sind sehr wichtige Prozesse in der physikalischen Chemie. Es gibt verschiedene Möglichkeiten, einen Ionisierungsprozess durchzuführen. Elektrolyse kann auch verwendet werden, um chemische Spezies zu ionisieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ionisation
3. Was ist Elektrolyse
4. Seite für Seitenvergleich -Ionisation gegen Elektrolyse in tabellarischer Form
5. Zusammenfassung
Was ist Ionisation?
Ionisation ist ein chemischer Prozess, bei dem Atome oder Moleküle eine positive oder negative Ladung erhalten. Es tritt aufgrund des Entfernens oder der Erlangung von Elektronen aus Atomen bzw. Molekülen auf. Hier werden die resultierenden Ionen als Kationen oder Anionen bezeichnet, abhängig von ihrer Anklage, die sie haben, ich.e. Kationen sind positiv geladene Ionen und Anionen sind negativ geladene Ionen. Grundsätzlich bildet der Verlust von Elektronen aus einem neutralen Atom oder einem Molekül ein Kation und die Gewinn von Elektronen aus einem neutralen Atom ladet ihm eine negative Ladung, wobei ein Anion bildet.
Wenn ein Elektron durch Zugabe von Energie aus einem neutralen gasförmigen Atom entfernt wird, bildet es ein einwertiges Kation. Es liegt daran, dass ein neutrales Atom eine gleiche Anzahl von Elektronen und Protonen hat, was zu keinem Nettoladung führt. Wenn wir ein Elektron aus diesem Atom entfernen, gibt es ein überschüssiges Proton, dem ein Elektron fehlt, um seine Ladung zu neutralisieren. Daher erhält dieses Atom eine Ladung von +1 (es ist die Ladung des Protons). Die dafür erforderliche Energiemenge ist die erste Ionisationsenergie dieses Atoms.
Außerdem ist die Ionisation, die in einer flüssigen Lösung stattfindet, die Bildung von Ionen in der Lösung. Zum Beispiel, wenn sich HCl -Moleküle in Wasser auflösen, Hydroniumionen (H)3Ö+) sind geformt. Hier reagiert HCl mit Wassermolekülen und bildet positiv geladene Hydroniumionen und negativ geladenes Chlorid (CL)-) Ionen.
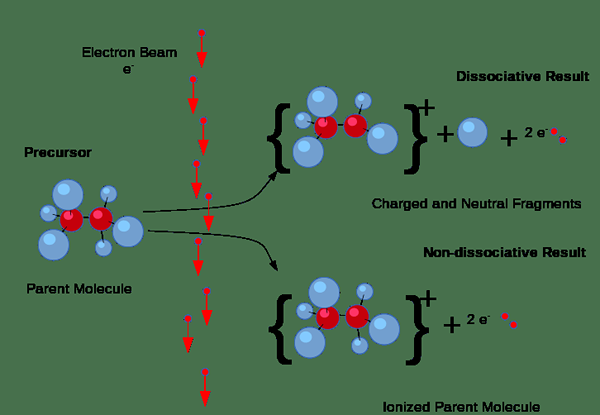
Darüber hinaus kann Ionisation durch Kollisionen auftreten. Diese Art der Ionisation erfolgt jedoch hauptsächlich in Gasen, wenn ein elektrischer Strom durch das Gas führt. Wenn die Elektronen im Strom eine ausreichende Menge an Energie haben, die zum Entfernen von Elektronen aus Gasmolekülen erforderlich ist, erzwingen sie Elektronen aus Gasmolekülen und produzieren Ionenpaare, die aus dem einzelnen positiven Ion und dem negativen Elektron bestehen. Hier bilden sich auch negative Ionen, da einige Elektronen dazu neigen, sich an Gasmolekülen zu befestigen, anstatt Elektronen herauszuziehen.
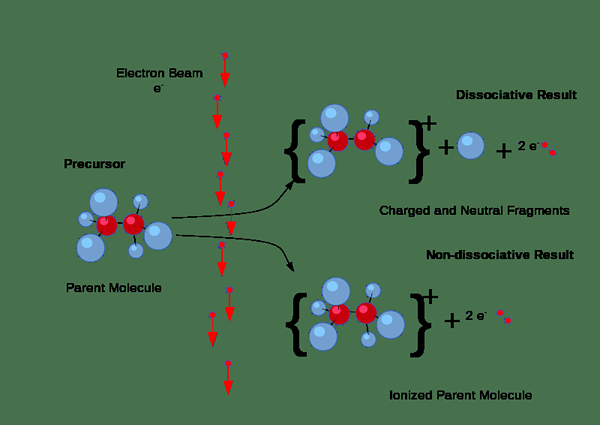
Abbildung 01: Ionisierungsprozess
Darüber hinaus tritt die Ionisation auf, wenn Strahlungsenergie oder ausreichend energiegeladen geladene Partikel durch Feststoffe, Flüssigkeiten oder Gase verlaufen; Zum Beispiel können Alpha -Partikel, Beta -Partikel und Gammastrahlung Substanzen ionisieren; Daher nennen wir sie als ionisierende Strahlung.
Was ist Elektrolyse?
Elektrolyse ist der Prozess der Verwendung eines direkten elektrischen Stroms, um eine nicht-spontane chemische Reaktion voranzutreiben. Wir können dies mit einer elektrolytischen Zelle tun. Die Technik der Elektrolyse ist wichtig, um eine Verbindung in ihre Ionen oder andere Komponenten zu trennen.
In der Elektrolyse führt ein elektrischer Strom eine Lösung für die Mobilität von Ionen in dieser Lösung durch. Eine elektrolytische Zelle enthält zwei Elektroden, die in dieselbe Lösung eingetaucht sind. Und diese Lösung ist der Elektrolyt. Ein wesentlicher Faktor bei der Regulierung der Elektrolytzelle ist „über Potential“. Wir müssen eine höhere Spannung liefern, um eine nicht-spontane Reaktion durchzuführen. Hier kann auch eine inerte Elektrode verwendet werden, um die Oberfläche für die auftretende Reaktion bereitzustellen.
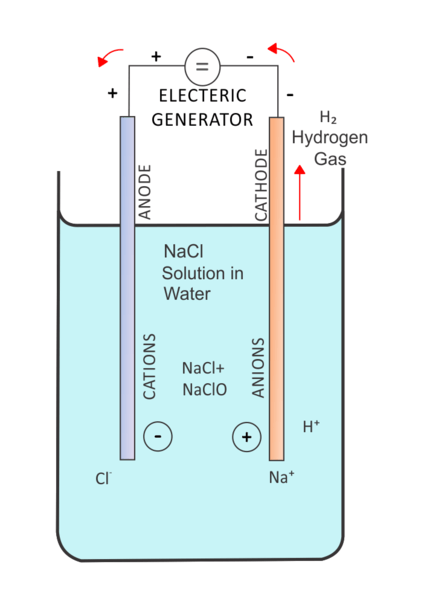
Abbildung 02: Elektrolyse einer Salzlösung
Es gibt viele Anwendungen der Elektrolyse. Eine gemeinsame Anwendung ist die Elektrolyse von Wasser. Hier ist Wasser der Elektrolyt. Dann erfolgt die Reaktion des Abbaues von Wassermolekülen in Wasserstoff- und Sauerstoffgase unter Verwendung des elektrischen Stroms, der durch den Elektrolyten geleitet wird.
Was ist der Unterschied zwischen Ionisation und Elektrolyse?
Ionisierung und Elektrolyse sind sehr wichtige Prozesse in der physikalischen Chemie. Der Hauptunterschied zwischen Ionisation und Elektrolyse besteht darin, dass die Ionisierung die Bildung chemischer Spezies mit elektrischer Ladung ist, während die Elektrolyse der Prozess der Verwendung eines elektrischen Stroms zur Durchführung einer nicht spontanen chemischen Reaktion ist.
Bei der Prüfung des Prozesses kann die Ionisierung aus mehreren Gründen wie der Reaktion zwischen einer neutralen Spezies und einem ionisierenden Mittel aufgrund von Kollisionen aufgrund ionisierender Strahlung usw. stattfinden. Alle diese Methoden führen jedoch entweder zur Entfernung oder Zugabe von Elektronen zu chemischen Komponenten, i.e. Das Entfernen eines Elektrons bildet ein Kation und das Erhalten eines Elektronens bildet einen Anion. Elektrolyse ist auch eine Methode, die wir zur Ionisierung von Verbindungen verwenden können. Dies ist also ein weiterer Unterschied zwischen Ionisation und Elektrolyse.

Zusammenfassung -Ionisation gegen Elektrolyse
Ionisierung und Elektrolyse sind sehr wichtige Prozesse in der physikalischen Chemie. Der Hauptunterschied zwischen Ionisation und Elektrolyse besteht darin, dass die Ionisierung die Bildung chemischer Spezies mit elektrischer Ladung ist, während die Elektrolyse der Prozess der Verwendung eines elektrischen Stroms zur Durchführung einer nicht spontanen chemischen Reaktion ist.
Referenz:
1. Helmenstine, Anne Marie. „Elektrolyse -Definition in der Chemie.”Thoughtco, Februar. 7, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Elektronisionisation" von Evan Mason - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Salzelektrolyse" von Sarah.Blumen - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


