Unterschied zwischen Atomwirtschaft und prozentualer Ertrag
Schlüsselunterschied - Atomwirtschaft im Prozentsatzertrag
Atomwirtschaft und prozentuale Ertrag werden verwendet, um die Effizienz der chemischen Synthese zu bestimmen. Die Bestimmung der Atomwirtschaft ist sehr wichtig, da sie Einzelheiten darüber gibt, wie umweltfreundlicher der Prozess ist. Es zeigt auch die Verschwendung von Atomen während des Prozesses an. Die prozentuale Ausbeute ist die Produktmenge, die durch eine chemische Reaktion in Bezug auf die erwartete berechnete Menge (die theoretische Menge) angegeben ist. Der Hauptunterschied zwischen Atomwirtschaft und prozentualer Ertrag besteht darin Die Atomwirtschaft wird berechnet, indem die Molmasse des gewünschten Produkts durch die Molmasse aller Reaktanten geteilt wird, während die prozentuale Ausbeute berechnet wird, indem die tatsächliche Ausbeute des Produkts aus der theoretischen Ausbeute des Produkts getaucht wird.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Atomwirtschaft?
3. Was ist prozentualer Ertrag
4. Ähnlichkeiten zwischen Atomwirtschaft und prozentualer Ertrag
5. Nebenseitiger Vergleich - Atomökonomie gegenüber prozentualer Ausbeute in tabellarischer Form
6. Zusammenfassung
Was ist Atomwirtschaft??
Atomwirtschaft oder Atom -Effizienz ist die Bestimmung der Effizienz einer chemischen Synthese in Bezug auf die während der Synthesereaktion verwendeten Atome. Wenn die Atomwirtschaft zu 100%beträgt, bedeutet dies, dass alle Atome, die in den Prozess beteiligt waren, während des Prozesses verwendet wurden. Dies bedeutet, dass alle Atome in den Reaktanten in Atome des Produkts umgewandelt wurden. Wenn die Atomwirtschaft eines Prozesses hoch ist, wird es als a genannt grüner Prozess.
Gleichung für die Berechnung der Atomwirtschaft
Die Bestimmung der Atomwirtschaft kann über die folgende Gleichung erfolgen.
Atomwirtschaft = (Molmasse der gewünschten Produkt/Molmasse aller Reaktanten) x 100%

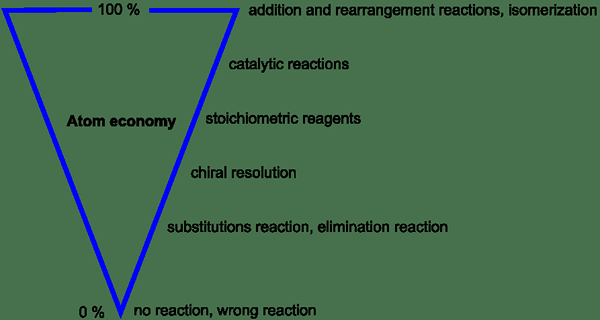
Abbildung 1: Variation der Atomwirtschaft basierend auf verschiedenen Parametern
In einem idealen Prozess werden alle Atome in den Reaktanten vom Prozess verbraucht und in Reaktanten umgewandelt. Daher wird kein Atom verschwendet. In den tatsächlichen Prozessen liegt die Atomwirtschaft jedoch niedriger als 100%. Dies liegt an der Produktion von Nebenprodukten, anstatt nur das gewünschte Produkt zu geben. Dies ist ein wichtiges Problem, wenn es um den Prozess geht, der kostengünstige Rohstoffe verbraucht.
Beispiel
Produktion von Maleinsanhydrid aus Benzol. Dies ist eine Oxidationsreaktion; Die am Prozess beteiligten Reaktanten sind Benzol- und molekularer Sauerstoff.
Benzol + 4.5oxygen → Maleinsanhydrid + 2Carbon -Dioxid + 2 Wasser
Molmasse des gewünschten Produkts = (12 × 4) + (16 × 3) + (1 × 2)
= 98 g/mol
Molmasse aller Reaktanten; Benzol = (12 × 6) + (1 × 6)
= 78 g/mol
Molekularer Sauerstoff = 4.5 (16 × 2)
= 144 g/mol
Die Gesamtmasse der Reaktanten = 78 + 144
= 222 g/mol
Atomwirtschaft = (98/222) x 100%
= 44.14%
Was ist prozentualer Ertrag?
Prozentuale Rendite (auch genannt prozentuale Ausbeute) ist die tatsächliche Ausbeute, die aus einer chemischen Synthesereaktion in Bezug auf die theoretische Ausbeute erhalten wird. Der Wert wird als Prozentsatz angegeben. Die tatsächliche Ausbeute erhalten wir aus dem Experiment, während die theoretische Ausbeute der Wert ist, der aus der Gleichung der chemischen Reaktion berechnet wird, unter Berücksichtigung der Stöchiometrie.
Bei der Berechnung der theoretischen Ausbeute sollte man das begrenzende Reagenz berücksichtigen. Begrenzung von Reagenzien oder Begrenzungsreaktanten ist der Reaktant, der bestimmt, wie viel von dem Produkt hergestellt wurde. Der limitierende Reaktant wird während der Reaktion verbraucht, bei der andere Reaktanten auch nach Abschluss der Reaktion bleiben, weil sie überschüssige Reagenzien sind.
So finden Sie das einschränkende Reagenz?
Ex: Betrachten wir die Reaktion zwischen Al (14 g) und CL2 (4.25 g) Gas. Das Endprodukt ist Alcl3.
2al+ 3cl2 → 2Alcl3
Die Maulwürfe von al vorhanden = 14 /26.98 = 0.52 mol
Die Maulwürfe von CL2 Präsent = 4.25 /70.90 = 0.06 mol
Stöchiometrisches Verhältnis zwischen Al und CL2 = 2: 3
Daher reagieren 2 Mol Al mit 3 Mol CL2. Dann Menge an CL2 erforderlich, um mit 0 zu reagieren.52 mol von Al ist = (3/2) x 0.52 = 0.78 mol
Aber nur 0.06 Mol ist vorhanden. Daher Cl2 ist das einschränkende Reagenz hier. Dann wird die theoretische Ausbeute unter Verwendung der im Reaktionsgemisch vorhandenen Menge berechnet.
Theoretische Ausbeute = (2/3) x 0.06 x 133.3 = 5.33 g
Wenn die tatsächliche Ausbeute aus dem Experiment als 4 angegeben ist.33G kann der prozentuale Rendite wie folgt berechnet werden.
Prozentuale Rendite = (4.33/5.33) x 100% = 81.24%
Was sind die Ähnlichkeiten zwischen Atomwirtschaft und prozentualer Ertragsrendite??
- Sowohl die Atomwirtschaft als auch die prozentuale Rendite sind Prozentsätze.
- Sowohl Atomwirtschaft als auch prozentuale Ertrag sind sehr nützlich, um die Effizienz eines chemischen Prozesses zu bestimmen.
Was ist der Unterschied zwischen Atomwirtschaft und prozentualer Ertrag?
Atomökonomie gegenüber prozentualen Rendite | |
| Atomwirtschaft ist die Bestimmung der Effizienz einer chemischen Synthese in Bezug auf die während der Synthesereaktion verwendeten Atome. | Prozentuale Ausbeute ist die tatsächliche Ausbeute, die aus einer chemischen Synthesereaktion in Bezug auf die theoretische Ausbeute erhalten wird. |
| Zweck | |
| Die Atomwirtschaft wird berechnet, um die Effizienz eines Prozesses abzuschätzen und die Atomeverschwendung zu bestimmen. | Die prozentuale Rendite wird berechnet, um die Produktmenge zu bestimmen, die praktisch im Vergleich zu den theoretischen Erwartungen angegeben ist. |
| Berechnung | |
| Die Atomwirtschaft wird berechnet, indem die Molmasse des gewünschten Produkts durch die Molmasse aller Reaktanten geteilt wird | Die prozentuale Ausbeute wird berechnet, indem die tatsächliche Ausbeute des Produkts aus der theoretischen Ausbeute des Produkts getaucht wird. |
Zusammenfassung -Atomökonomie gegenüber prozentualen Ertrag
Atomwirtschaft und prozentuale Ertrag sind Prozentwerte, die in Bezug auf chemische Reaktionen berechnet werden. Der Hauptunterschied zwischen Atomwirtschaft und prozentualer Ertrag besteht darin, dass die Atomwirtschaft berechnet wird, indem die Molmasse des gewünschten Produkts durch die Molmasse aller Reaktanten geteilt wird, während der prozentuale Ertrag berechnet wird, indem die tatsächliche Ausbeute des Produkts aus der theoretischen Ausbeute von getaucht wird das Produkt.
Referenz:
1. „Begrenzung von Reagenzien und prozentualen Ertrag.Khan Academy, hier erhältlich.
2. „Atomwirtschaft.”Wikipedia, Wikimedia Foundation, 28. Februar. 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1."Atom Economy V3 en" von Astrid 91 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


