Unterschied zwischen Atommasse und Molekulargewicht
Der Schlüsselunterschied Zwischen Atommasse und Molekulargewicht befindet sich die Atommasse ist die Masse eines einzelnen Atoms, während das Molekulargewicht die Summe der Gewichte der Atome im Molekül ist.
Atome sind die Bausteine aller Materie. Ein Atom hat Gewicht; Es ist atomare Masse. Atome können sich in verschiedenen Kombinationen zusammenschließen, um Moleküle und andere Verbindungen zu bilden. Molekulare Strukturen geben die genauen Verhältnisse von Atomen an; Somit können wir molekulare Formeln für Verbindungen schreiben. Diese sind wichtig für die Bestimmung des Molekulargewichts.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Atommasse
3. Was ist Molekulargewicht
4. Seite an Seitenvergleich - Atommasse gegen Molekulargewicht in tabellarischer Form
5. Zusammenfassung
Was ist Atommasse?
Atome enthalten hauptsächlich Protonen, Neutronen und Elektronen. Atommasse ist einfach die Masse eines Atoms. Mit anderen Worten, es ist die Sammlung von Massen aller Neutronen, Protonen und Elektronen in einem einzelnen Atom, insbesondere wenn sich das Atom nicht bewegt (Ruhmasse). Wir nehmen die Masse in der Ruhe, weil nach den Grundlagen der Physik, wenn sich Atome mit sehr hoher Geschwindigkeit bewegen, die Massen zunehmen.
Die Masse eines Elektrons ist jedoch im Vergleich zu den Massen von Protonen und Neutronen erheblich sehr gering. Daher können wir sagen, dass der Beitrag der Elektronen zu einer Atommasse geringer ist. Die meisten Atome in der Periodenzüchter haben zwei oder mehr Isotope. Isotope unterscheiden. Da ihre Neutronenmenge unterschiedlich ist, hat jedes Isotop eine andere Atommasse.

Abbildung 01: Atommassen chemischer Elemente
Darüber hinaus sind die Atomemassen extrem klein; Daher können wir sie nicht in normalen Masseneinheiten wie Gramm oder Kilogramm ausdrücken. Für unsere Zwecke verwenden wir eine andere Einheitsanruf -Atommasseneinheit (AMU), um die Atommasse zu messen. 1 Atommasseneinheit ist der Ein-Zwölf der Masse eines C-12-Isotops. Wenn wir die Masse eines Atoms durch die Masse der Masse der Masse eines C-12-Isotops teilen, können wir seine relative Masse bekommen. Im allgemeinen Gebrauch, wenn wir die relative Atommasse eines Elements sagen, meinen wir ihr Atomgewicht (weil wir sie unter Berücksichtigung aller Isotope berechnen).
Was ist Molekulargewicht?
Molekulargewicht ist die Sammlung von Gewichten aller Atome in einem Molekül. Die Si -Einheit dieses Parameters ist GMOL-1. Dies gibt die Menge der Atome/Moleküle/Verbindungen in einem Mol der Substanz. Mit anderen Worten, es ist die Masse der Avogadro -Anzahl von Atomen/Molekülen oder Verbindungen.
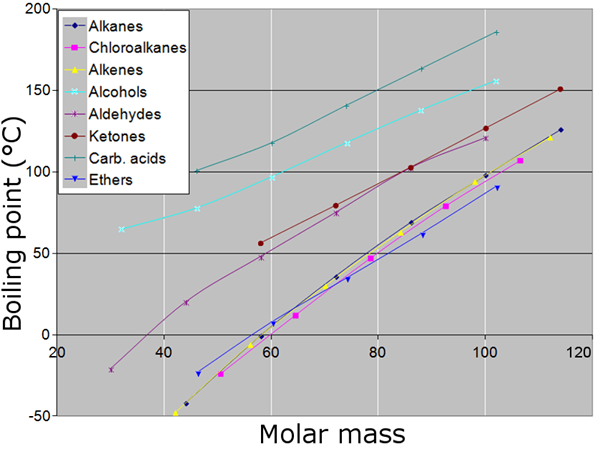
Abbildung 02: Siedepunkte und Molmassen (Molekulargewichte) verschiedener Verbindungen
Es ist wichtig, das Gewicht von Atomen und Molekülen im praktischen Szenario zu messen. Es ist jedoch schwierig, sie als einzelne Partikel zu wiegen, da ihre Massen entsprechend den normalen Wiegeparametern (Gramm oder Kilogramm) extrem klein sind. Um diese Lücke zu erfüllen und die Partikel auf makroskopischer Ebene zu messen, ist das Molmassenkonzept sehr nützlich.
Die Definition des Molekulargewichts bezieht sich direkt auf das Carbon-12-Isotop. Die Masse eines Maulwurfs Kohlenstoff -12 -Atome beträgt genau 12 Gramm, die Molmasse beträgt genau 12 Gramm pro Maulwurf. Darüber hinaus können wir das Molekulargewicht von Molekülen berechnen, die dieselben Atome wie O enthalten2 oder n2 Durch Multiplizieren der Anzahl der Atome mit dem Atomgewicht der Atome. Das Molekulargewicht der Verbindungen wie NaCl oder Cuso4 wird berechnet, indem die Atomgewichte jedes Atoms hinzugefügt werden.
Was ist der Unterschied zwischen Atommasse und Molekulargewicht?
Atommasse gibt die Masse der Atome an, während das Molekulargewicht die Masse von Molekülen ergibt. Der Schlüsselunterschied zwischen Atommasse und Molekulargewicht besteht jedoch darin, dass die Atommasse die Masse eines einzelnen Atoms ist, während das Molekulargewicht die Summe der Gewichte der Atome im Molekül ist. Als ein weiterer signifikanter Unterschied zwischen Atommasse und Molekulargewicht ist die Messeinheit der Atommasse AMU, während die Einheit für das Molekulargewicht G/Mol beträgt.
Darüber hinaus gibt es einen Unterschied zwischen Atommasse und Molekulargewicht in der Art und Weise, wie wir diese beiden Größen berechnen. Wir können die Atommasse leicht bestimmen, indem wir die Massen von Neutronen, Protonen und Elektronen des Atoms hinzufügen. Wir bestimmen jedoch die Masse eines Moleküls oder das Molekulargewicht eines Moleküls, indem wir die durchschnittlichen Atomemassen im Molekül hinzufügen.
Die folgende Abbildung zeigt den Unterschied zwischen Atommasse und Molekulargewicht in tabellarischer Form.
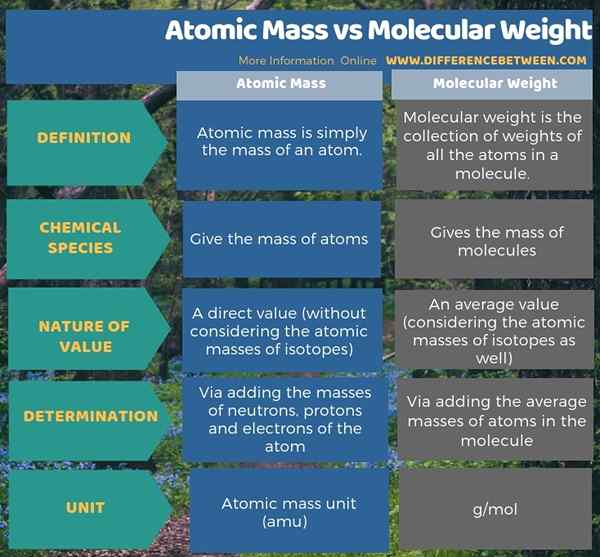
Zusammenfassung -Atommasse gegen Molekulargewicht
Wir verwenden die Begriffe Atommasse und Molekulargewicht hauptsächlich im allgemeinen Chemieberechnungen, um die Werte in Bezug auf chemische Reaktionen zu bestimmen. wie die Anzahl der Reaktanten, Produkte usw. Der Schlüsselunterschied zwischen Atommasse und Molekulargewicht besteht darin, dass die Atommasse die Masse eines einzelnen Atoms ist, während das Molekulargewicht die Summe der Gewichte der Atome im Molekül ist.
Referenz:
1.Helmenstine, Anne Marie, ph.D. „Wie man die Atommasse berechnet.”Thoughtco, dec. 5, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Periodische Tabelle der Elemente Atommasse Schwarz und Weiß” von DMARCUS100 - eigene Arbeit (CC BY -SA 4).0) über Commons Wikimedia
2."Boiling Point vs Mol Mass Graph" von JPTA - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia


