Unterschied zwischen Atommasseneinheit und Atommasse
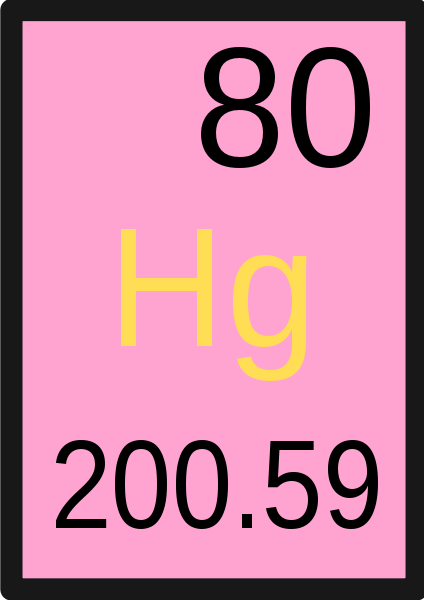
Der Schlüsselunterschied Zwischen Atommasseneinheit und Atommasse befindet sich die Atommasseneinheit ist die Einheit, mit der wir die Masse eines Atoms messen, während die Atommasse die Masse eines bestimmten einzelnen Atoms ist.
Das Ausdrücken der Gewichte von Atomen oder Molekülen war ein Problem für Wissenschaftler in den frühen Stadien. Da Atome extrem klein sind, können wir ihre Massen nicht mit regulären Einheiten wie Kilogramm oder Gramm oder sogar in Mikrogramm messen. Daher haben Wissenschaftler ein neues Konzept entwickelt, um diese zu messen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Atommasseneinheit
3. Was ist Atommasse
4. Seite an Seitenvergleich - Atommasseeinheit gegen Atommasse in tabellarischer Form
5. Zusammenfassung
Was ist Atommasseneinheit?
Die Massen von Atomen sind extrem klein. Daher können wir sie nicht in normalen Masseneinheiten wie Gramm oder Kilogramm ausdrücken. Daher müssen wir eine andere Einheit namens Atomic Mass Unit (AMU) verwenden, um die Atommasse zu messen. Eine atomare Masseneinheit ist ein zweitfertiger Masse eines C-12-Isotops, das 1 ist.66 x 10–27 kg. Wenn wir die Masse eines Atoms durch ein-zweitelndes Masse eines C-12-Isotops teilen, können wir seine relative Masse bekommen. Und dieser Wert ist eine kleine Zahl, die in Berechnungen und für andere Zwecke einfach zu verwenden ist. Im Allgemeinen verwenden wir jedoch, wenn wir die relative Atommasse eines Elements sagen, ihr Atomgewicht (weil wir sie unter Berücksichtigung aller Isotope berechnen).
Vor der Verwendung von Carbon-12 als Standard für die Messung der Atommasseneinheit verwendeten die Menschen andere Elemente. Zum Beispiel wurde H-1 zuerst verwendet. Später haben sie dies geändert, um die Fehler zu reduzieren. Danach verwendeten sie Elemente mit höheren Massen. Der nächste Standard war Sauerstoff-16. Später wurde die Atommasseneinheit mit der Entdeckung des Vorhandenseins von Sauerstoffisotopen und anderen damit verbundenen Problemen im Verhältnis zu Kohlenstoff-12-Isotop gemessen.
Was ist Atommasse?
Atome enthalten hauptsächlich Protonen, Neutronen und Elektronen. Atommasse ist einfach die Masse eines Atoms. Mit anderen Worten, es ist die Sammlung von Massen aller Neutronen, Protonen und Elektronen in einem einzelnen Atom, insbesondere wenn sich das Atom nicht bewegt (Ruhmasse). Wir sollten die Ruhemasse einnehmen.
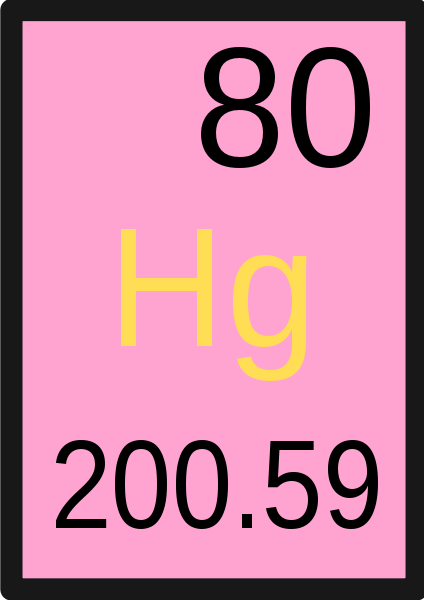
Abbildung 01: Die Atommasse des Quecksilbers beträgt 200.59 Amu
Die Masse der Elektronen ist jedoch im Vergleich zu den Massen von Protonen und Neutronen erheblich gering. Daher können wir sagen, dass der Beitrag eines Elektrons zur Atommasse geringer ist. Die meisten Atome in der Periodenzüchter haben zwei oder mehr Isotope. Isotope unterscheiden. Da ihre Neutronenmenge unterschiedlich ist, hat jedes Isotop eine andere Atommasse. Der Durchschnitt der gesamten Isotopenmasse ist das Atomgewicht. Daher ist die Masse eines bestimmten Isotops die Atommasse in einem Atom, das mehrere Isotope hat.
Was ist der Unterschied zwischen Atommasseneinheit und Atommasse?
Atommasse ist die Masse eines bestimmten Atoms (ohne die durchschnittliche Masse von Isotopen). Atommasseneinheit ist das 1/12 der Masse von Kohlenstoff -12 -Isotopen. Daher besteht der Hauptunterschied zwischen Atommasseneinheit und Atommasse darin, dass die Atommasseneinheit die Einheit ist, mit der wir die Masse eines Atoms messen, während Atommasse die Masse eines bestimmten einzelnen Atoms ist. Darüber hinaus können wir die Atommasseneinheit verwenden, um die relativen Massen anderer Atome im Verhältnis zur C-12-Masse anzuzeigen.
Die folgende Infografik über den Unterschied zwischen Atommasseneinheit und Atommasse fasst alle diese Unterschiede zusammen.
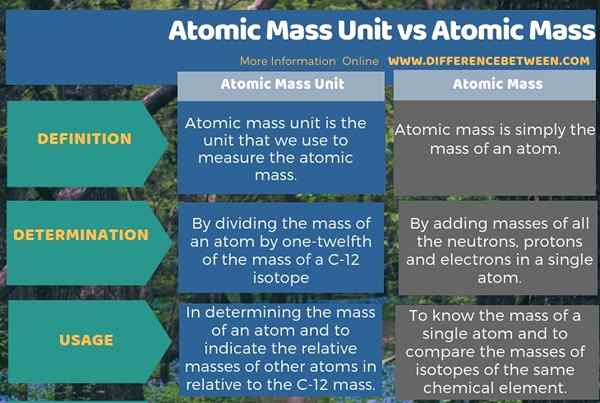
Zusammenfassung -Atommasseneinheit gegen Atommasse
Atommasseneinheit ist die Messungseinheit der Atommasse eines einzelnen Atoms. Der Hauptunterschied zwischen Atommasseneinheit und Atommasse besteht darin, dass die Atommasseneinheit die Einheit ist, mit der wir die Masse eines Atoms messen, während die Atommasse die Masse eines bestimmten Atoms ist.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Atommasse und Atommassenzahl (Schnelle Bewertung).”Thoughtco, Jun. 13, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Mercury (Element)” von mir (CC BY-SA 2.5) über Commons Wikimedia


