Unterschied zwischen Bohr und Quantenmodell
Schlüsselunterschied - Bohr gegen Quantenmodell
Das BOHR -Modell und das Quantenmodell sind Modelle, die die Struktur eines Atoms erklären. Das Bohr-Modell wird auch als Rutherford-Bohr-Modell bezeichnet, da es sich um eine Modifikation des Rutherford-Modells handelt. Das Bohr -Modell wurde 1915 von Niels Bohr vorgeschlagen. Quantenmodell ist das moderne Modell eines Atoms. Der Schlüsselunterschied zwischen Bohr und Quantenmodell ist das BOHR -Modell besagt, dass Elektronen sich als Partikel verhalten wohingegen Quantenmodell erklärt, dass das Elektron sowohl Partikel- als auch Wellenverhalten hat.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Bohr -Modell
3. Was ist Quantenmodell
4. Seite für Seitenvergleich - Bohr gegen Quantenmodell in tabellarischer Form
5. Zusammenfassung
Was ist das Bohr -Modell?
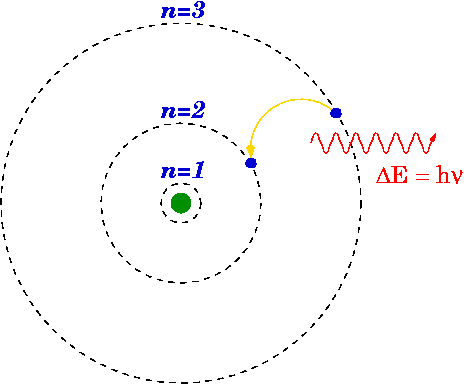
Wie oben erwähnt, ist das BOHR -Modell eine Modifikation des Rutherford -Modells, da das Bohr -Modell die Struktur des Atoms erklärt, die aus einem von Elektronen umgebenen Kern besteht. Aber das Bohr -Modell ist fortgeschrittener als das Rutherford -Modell, da die Elektronen immer in bestimmten Schalen oder Umlaufbahnen rund um den Kern reisen. Dies besagt auch, dass diese Schalen unterschiedliche Energien haben und kugelförmige Form haben. Dies wurde durch Beobachtungen der Linienspektren für das Wasserstoffatom vorgeschlagen.
Aufgrund des Vorhandenseins diskreter Linien in den Linienspektren erklärte Bohr, dass die Orbitale eines Atoms feste Energien und Elektronen von einem Energieniveau zum anderen emittieren oder absorbierenden Energie haben können, was zu einer Linie in den Linienspektren führt.
Hauptpostulate des Bohr -Modells
-
Die Elektronen bewegen sich in kugelförmigen Orbitalen um den Kern, die eine feste Größe und Energie haben.
- Jede Umlaufbahn hat einen anderen Radius und wird von Kern nach außen als n = 1, 2, 3 usw. benannt. oder n = k, l, m usw. wobei n die Anzahl der festen Energienebene ist.
- Die Energie eines Orbitals hängt mit seiner Größe zusammen.
- Die kleinste Umlaufbahn hat die niedrigste Energie. Das Atom ist vollständig stabil, wenn sich die Elektronen in der niedrigsten Energieniveau befinden.
- Wenn sich ein Elektron in einem bestimmten Orbital bewegt, ist die Energie dieses Elektrons konstant.
- Elektronen können sich von einem Energieniveau zum anderen bewegen, indem sie Energie absorbieren oder freisetzen.
-
Diese Bewegung verursacht Strahlung.
BOHR -Modell passt perfekt zum Wasserstoffatom, das ein einzelnes Elektron und einen kleinen positiv geladenen Kern aufweist. Abgesehen davon verwendete Bohr die Konstante des Planks, um die Energie der Energieniveaus des Atoms zu berechnen.

Abbildung 01: Das Bohr -Modell für Wasserstoff
Es gab jedoch nur wenige Nachteile des BOHR -Modells, wenn sie die Atomstruktur von anderen Atomen als Wasserstoff erklärte.
Einschränkungen des Bohr -Modells
- Das BOHR -Modell konnte den Zeeman -Effekt nicht erklären (Effekt des Magnetfeldes auf das Atomspektrum).
- Es konnte den starken Effekt nicht erklären (Effekt des elektrischen Feldes auf das Atomspektrum).
- Das Bohr -Modell erklärt die Atomspektren größerer Atome nicht.
Was ist Quantenmodell?
Obwohl das Quantenmodell viel schwerer zu verstehen ist als das Bohr -Modell, erklärt es die Beobachtungen in Bezug auf die großen oder komplexen Atome genau. Dieses Quantenmodell basiert auf der Quantentheorie. Nach der Quantentheorie hat ein Elektron eine Partikelwellen-Dualität und es ist unmöglich, die genaue Position des Elektrons (Unsicherheitsprinzip) zu lokalisieren. Daher basiert dieses Modell hauptsächlich auf der Wahrscheinlichkeit eines Elektrons, das sich überall im Orbital befindet. Es heißt auch, dass die Orbitale nicht immer kugelförmig sind. Die Orbitale haben bestimmte Formen für unterschiedliche Energieniveaus und sind 3D -Strukturen.
Nach dem Quantenmodell kann ein Elektron unter Verwendung von Quantennummern ein Name erhalten. Danach werden vier Arten von Quantenzahlen verwendet;
- Prinzip -Quantenzahl, n
- Quantenzahl der Drehimpuls, ich
- Magnetische Quantenzahl, ml
- Spin -Quantenzahl, mS
Der Prinzip Quantenzahl erklärt den durchschnittlichen Abstand des Orbitals vom Kern und des Energieniveaus. Der Quantenzahl der Drehimpuls erklärt die Form des Orbitals. Der Magnetische Quantenzahl beschreibt die Ausrichtung von Orbitalen im Raum. Der Quantenzahl Spin gibt das Spinnen eines Elektrons in einem Magnetfeld und die Welleneigenschaften des Elektrons.
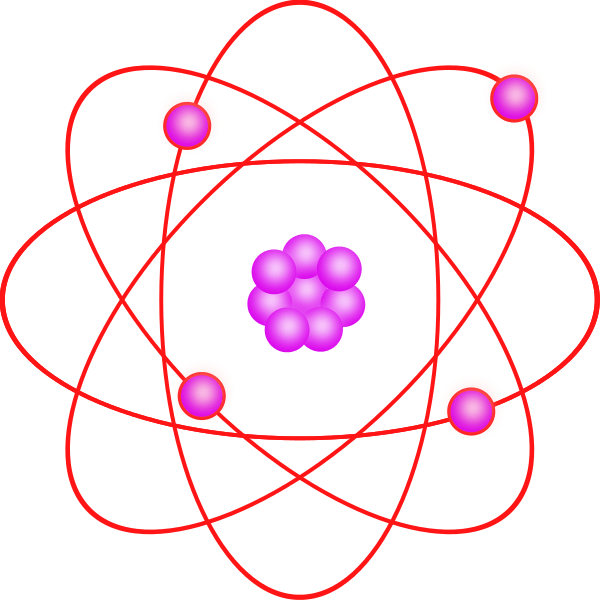
Abbildung 2: räumliche Struktur von Atomorbitalen.
Was ist der Unterschied zwischen Bohr und Quantenmodell?
Bohr gegen Quantenmodell | |
| BOHR -Modell ist ein Atommodell, das von Niels Bohr (1915) vorgeschlagen wurde, um die Struktur eines Atoms zu erklären. | Quantenmodell ist ein Atommodell, das als modernes Atommodell angesehen wird, um die Struktur eines Atoms genau zu erklären. |
| Verhalten von Elektronen | |
| Das Bohr -Modell erklärt das Partikelverhalten eines Elektrons. | Quantenmodell erklärt die Wellenpartikel-Dualität eines Elektrons. |
| Anwendungen | |
| BOHR -Modell kann für Wasserstoffatom angewendet werden, jedoch nicht für große Atome. | Quantenmodell kann für jedes Atom verwendet werden, einschließlich kleinerer und großer, komplexer Atome. |
| Form der Orbitale | |
| Das Bohr -Modell beschreibt nicht die genauen Formen jedes Orbitals. | Das Quantenmodell beschreibt alle möglichen Formen, die ein Orbital haben kann. |
| Elektromagnetische Effekte | |
| BOHR -Modell erklärt nicht den Zeeman -Effekt (Effekt des Magnetfeldes) oder den starken Effekt (Effekt des elektrischen Feldes). | Das Quantenmodell erklärt genau die Zeeman- und Starkeffekte. |
| Quantenzahlen | |
| BOHR -Modell beschreibt nicht die Quantenzahlen als die Prinzip -Quantenzahl. | Das Quantenmodell beschreibt alle vier Quantenzahlen und die Eigenschaften eines Elektrons. |
Zusammenfassung - Bohr gegen Quantenmodell
Obwohl von Wissenschaftlern verschiedene Atommodelle vorgeschlagen wurden, waren die bemerkenswertesten Modelle BOHR -Modell und Quantenmodell. Diese beiden Modelle sind eng miteinander verbunden, aber das Quantenmodell ist viel detaillierter als das Bohr -Modell. Nach dem Bohr -Modell verhält sich ein Elektron als Teilchen, während das Quantenmodell erklärt, dass das Elektron sowohl Partikel- als auch Wellenverhalten aufweist. Dies ist der Hauptunterschied zwischen Bohr und Quantenmodell.
Laden Sie die PDF -Version des Bohr vs Quantenmodell herunter
Sie können die PDF -Version dieses Artikels herunterladen und ihn für Offline -Zwecke gemäß Zitatnotizen verwenden. Bitte laden Sie die PDF -Version hier den Unterschied zwischen BOHR und Quantenmodell herunter.
Verweise:
1. „BOHR -Modell eines Atoms | SCHRODinger Atomic Theory." Chemie. Byjus -Klassen, 08. November. 2016. Netz. Hier verfügbar. 05. Juni 2017.
2. „Atomstruktur: das quantenmechanische Modell.Dummies. N.P., N.D. Netz. Hier verfügbar. 05. Juni 2017.
Bild mit freundlicher Genehmigung:
1. "Bohr Model Balmer 32" (CC BY-SA 3.0) über Commons Wikimedia
2. "Atom Clipart Violet" (Public Domain) über Commons Wikimedia


