Unterschied zwischen Bindungsenergie und Bindungsdissoziationsenergie
Der Schlüsselunterschied zwischen Bindungsergie und Bindungsdissoziationsenergie ist, dass die Die Bindungsenergie ist ein Durchschnittswert, während die Bindungsdissoziationsenergie für eine bestimmte Bindung ein bestimmter Wert ist.
Wie vom amerikanischen Chemiker G vorgeschlagen.N.Lewis, Atome sind stabil, wenn sie acht Elektronen in ihrer Valenzschale enthalten. Die meisten Atome haben weniger als acht Elektronen in ihren Valenzschalen (mit Ausnahme der edlen Gase in Gruppe 18 des Periodenzüchtertabels); Daher sind sie nicht stabil. Daher reagieren diese Atome dazu, miteinander zu reagieren, um stabil zu werden. Es kann durch Bildung von Ionenbindungen, kovalenten Bindungen oder metallischen Bindungen in Abhängigkeit von der Elektronegativität von Atomen auftreten. Wenn zwei Atome einen ähnlichen oder sehr niedrigen Elektronegativitätsunterschied aufweisen, reagieren sie zusammen, indem sie eine kovalente Bindung bilden, indem sie Elektronen teilen. Bindungsenergie- und Bindungsdissoziationsenergie sind zwei Konzepte in Bezug auf kovalente chemische Bindungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Bindungsenergie
3. Was ist Bindungsdissoziationsenergie
4. Seite an Seitenvergleich - Bindungsenergie gegen Bindung Dissoziationsenergie in tabellarischer Form
5. Zusammenfassung
Was ist Bindungsenergie?
Wenn sich Bindungen bilden, gibt eine gewisse Menge an Energieversorgungen. Im Gegensatz dazu erfordert das Bond -Brechen ein gewisses Maß an Energie. Für eine bestimmte chemische Bindung ist diese Energie konstant. Und wir nennen es als Bond -Energie. Bindungsenergie ist daher die Wärmemenge.
Darüber hinaus können wir die Energie einer chemischen Bindung in verschiedenen Formen als chemische Energie, mechanische Energie oder elektrische Energie beobachten. Letztendlich wandeln sich alle diese Energien jedoch in Hitze um. Daher können wir die Bindungsenergie in Kilojoule oder Kilokalorie messen.

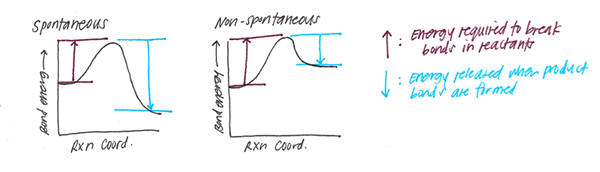
Abbildung 01: Bindungsenergie
Darüber hinaus ist die Bindungsenergie ein Indikator für die Bindungsstärke. Zum Beispiel sind stärkere Bindungen schwer zu spalten. Daher sind die Bindungssenergien von ihnen größer. Auf der anderen Seite haben schwache Bindungen kleine Bindungssenergien, und sie sind leicht zu spalten. Bindungsenergie zeigt auch den Bindungsabstand an. Höhere Bindungssenergien bedeuten, dass der Bindungsabstand niedrig ist (daher ist die Bindungsstärke hoch). Darüber hinaus, wenn die Bindungsenergie niedriger Bindungsabstand ist. Wie in der Einleitung erwähnt, spielt die Elektronegativität eine Rolle bei der Bildung von Bindungen. Daher trägt die Elektronegativität der Atome auch zur Bindungsenergie bei.
Was ist Bindungsdissoziationsenergie?
Bindungsdissoziationsenergie ist auch eine Messung der Bindungsstärke. Wir können es als die Enthalpieänderung definieren. Die Dissoziationsenergie der Bindung ist spezifisch für eine einzige Bindung.
In diesem Fall kann dieselbe Bindung je nach Situation unterschiedliche Dissoziationsenergien aufweisen. Zum Beispiel gibt es vier C-H-Bindungen in einem Methanmolekül, und alle C-H-Bindungen haben nicht die gleiche Bindungsdissoziationsenergie.

Abbildung 02: Einige Bindungsdissoziationsenergien für Koordinationskomplexe
Daher betragen Bindungsdissoziationsenergien für C-H-Bindungen im Methanmolekül 439 kJ/mol, 460 kJ/mol, 423 kJ/mol und 339 kJ/mol. Dies liegt daran. Ebenso ändert sich die Bindungsdissoziationsenergien Schritt für Schritt.
Was ist der Unterschied zwischen Bindungsenergie und Bindungsdissoziationsenergie?
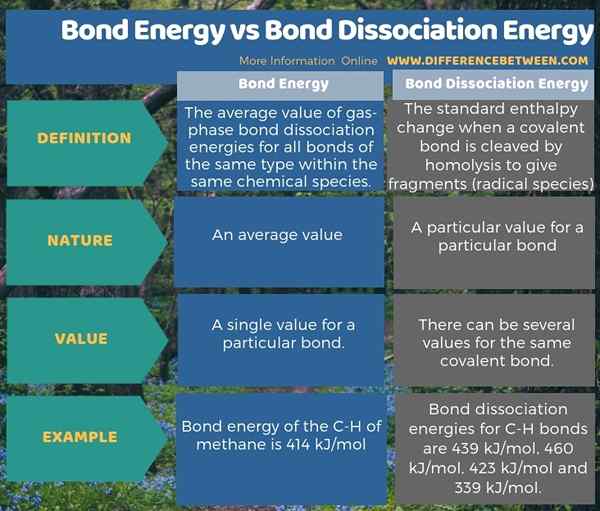
Bindungsenergie ist der Durchschnittswert der Gasphasenbindungsdissoziationsenergien (normalerweise bei einer Temperatur von 298 K) für alle Bindungen desselben Typs innerhalb derselben chemischen Spezies. Die Energie- und Bindungsdissoziationsenergie sind jedoch nicht gleich. Bindungsdissoziationsenergie ist die Standardänderung der Enthalpie, wenn eine kovalente Bindung durch Homolyse gespalten wird, um Fragmente zu ergeben. die normalerweise radikale Arten sind. Daher besteht die wichtigste Differenz zwischen Bindungsenergie und Bindungsdissoziationsenergie darin, dass die Bindungsenergie ein Durchschnittswert ist, während Bindungsdissoziationsenergie für eine bestimmte Bindung ein bestimmter Wert ist.
Zum Beispiel im Methanmolekül betragen Bindungsdissoziationsenergien für C-H-Bindungen 439 kJ/mol, 460 kJ/mol, 423 kJ/mol und 339 kJ/mol. Die Bindungsenergie des C-H von Methan beträgt jedoch 414 kJ/mol, was der Durchschnitt aller vier Werte ist. Darüber hinaus ist für ein Molekül die Bindungsdissoziationsenergie möglicherweise nicht unbedingt gleich der Bindungsenergie (wie für das oben gegebene Beispiel für Methan)). Für ein zweidomisches Molekül sind Bindungsenergie und die Bindungsdissoziationsenergie gleich.
Nachfolgend in der Infografik über den Unterschied zwischen Bindungsergie und Bindungsdissoziationsenergie liefert mehr Details zu den Unterschieden.
Zusammenfassung -Bindungsenergie gegen Bindungsdissoziationsenergie
Die Dissoziationsenergie der Bindung unterscheidet sich von der Bindungsenergie. Bindungsenergie ist der Durchschnittswert aller Bindungsdissoziationsenergien eines Moleküls. Daher besteht die Schlüsselunterschiede zwischen Bindungsenergie und Bindungsdissoziationsenergie darin, dass die Bindungsenergie ein Durchschnittswert ist, während die Bindungsdissoziationsenergie für eine bestimmte Bindung ein bestimmter Wert ist.
Referenz:
1. „Bindungsdissoziationsenergie.Wikipedia, Wikimedia Foundation, 5. Januar. 2019. Hier verfügbar
2. Libretexten. „Bond -Energien.”Chemistry Libretexten, National Science Foundation, 26. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Bond -Energiediagramme" von Fbarreyro - eigene Arbeit, (Public Domain) über Commons Wikimedia
2."Bond Energies" von Chem540f09grp8 - eigene Arbeit (Public Domain) über Commons Wikimedia


