Unterschied zwischen Bindungsenergie und Bindungsenthalpie
Schlüsselunterschied - Bindungsergie gegen Bindung Enthalpie
Sowohl die Bindungsenergie als auch die Bindungsenthalpie beschreiben das gleiche chemische Konzept; Die Menge an Energie, die erforderlich ist, um einen Mol von Molekülen in seine Komponentenatome auseinanderzusetzen. Dies misst die Stärke einer chemischen Bindung. Daher wird es auch als Bindungsstärke bezeichnet. Die Bindungsenergie wird als Durchschnittswert der Bindungsdissoziationsenergien bei 298 K für chemische Spezies in der gasförmigen Phase berechnet. Es gibt keinen erheblichen Unterschied zwischen den Begriffen Bond -Energie und Bindungsenthalpie, aber nicht Anleiheergie wird durch „E“ bezeichnet, während die Bondenthalpie mit „H) bezeichnet wird”.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Bindungsenergie
3. Was ist Bondenthalpie
4. Seite für Seitenvergleich - Bindungsenergie gegen Bindung Enthalpie in tabellarischer Form
5. Zusammenfassung
Was ist Bindungsenergie?
Bindungsenergie oder Bindungsenthalpie ist ein Maß für die Bindungsstärke. Bindungsenergie ist die Menge an Energie, die erforderlich ist, um einen Mol Moleküle in seine Komponentenatome auseinanderzusetzen. Dies bedeutet, dass Bindungsenergie die Energie ist, die erforderlich ist, um eine chemische Bindung zu brechen. Anleiheergie wird als "e" bezeichnet. Die Messeinheit ist kj/mol.
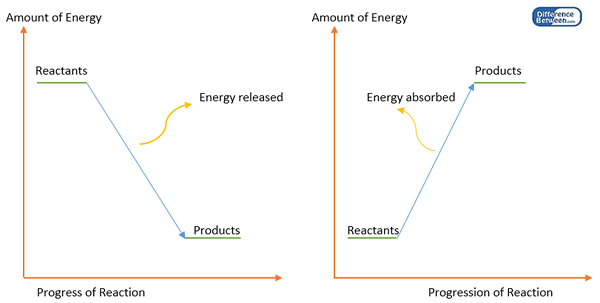
Zwischen Atomen werden chemische Bindungen gebildet, um einen stabilen Zustand zu erhalten, wenn die einzelnen Atome eine hohe Energie aufweisen, die instabil ist. Dies bedeutet, dass die Bildung chemischer Bindungen die Energie eines Systems verringert. Daher wird ein Teil der Energie (normalerweise als Wärme) bei der Bildung chemischer Bindungen freigesetzt. Daher ist die Bindungsbildung eine exotherme Reaktion. Um diese chemische Bindung zu brechen, sollte Energie bereitgestellt werden (eine gleiche Menge an Energie wie die Energie, die während der Bildung von Bindungen freigesetzt wird). Diese Energiemenge ist als Bond -Energie oder Bindungsenthalpie bekannt.

Abbildung 1: Energiediagramm für die Bindungsbildung (links) und die Bindungsdissoziation (rechts).
Die Bindungsenergie entspricht der Differenz zwischen der Enthalpie von Produkten (Atomen) und Reaktanten (Startmolekül). Jedes Molekül sollte seine eigenen Bindungsenergiewerte haben. Aber es gibt Ausnahmen. Zum Beispiel hängt die Bindungsenergie der C-H-Bindung vom Molekül ab, in dem die Bindung auftritt. Daher wird die Bindungsenergie als Durchschnittswert der Bindungsdissoziationsenergien berechnet.
Die Bindungsenergie ist die durchschnittliche Dissoziationsenergien für die Bindung für dieselbe Spezies in der gasförmigen Phase (bei 298 K -Temperatur). Zum Beispiel die Bindungsenergie des Methanmoleküls (CH4) ist die Energiemenge, die erforderlich ist, um ein Kohlenstoffatom und 4 Wasserstoffradikale zu bilden. Dann kann die Bindungsenergie von C-H-Bindung berechnet werden, indem die Summe der Bindungsdissoziationsenergien jeder C-H-Bindung und des Gesamtwerts durch 4 geteilt wird.
Beispiel: Bindungsenergie der O-H-Bindung in h2O Molekül kann wie folgt berechnet werden.
Energiemenge, die erforderlich ist, um die H-OH-Bindung zu brechen = 498.7 kJ/mol
Die Energiemenge, die erforderlich ist, um die O-H-Bindung zu brechen (im verbleibenden OH-radikal) = 428 kJ/mol
Die durchschnittliche Dissoziationsenergie = (498).7 + 428) / 2
= 463.35 kJ/mol ≈ 464 kJ/mol
Daher die Bindungsenergie von O-H in h2O Molekül wird als 464 kJ/mol angesehen.
Was ist Bondenthalpie?
Bindungsenthalpie oder Bindungsenergie ist die Energiemenge, die erforderlich ist, um ein Molekül in seine atomaren Komponenten zu trennen. Es ist ein Maß für die Bindungsstärke. Die Anleiheenthalpie wird als "H" bezeichnet.
Was ist der Unterschied zwischen Bindungsenergie und Bindungsenthalpie?
- Bindungsenergie- oder Bindungsenthalpie ist die Menge an Energie, die erforderlich ist, um einen Mol Moleküle in seine Komponentenatome auseinanderzusetzen.
- Anleiheergie wird als „e“ bezeichnet, während die Bondenthalpie als „H“ bezeichnet wird.
Zusammenfassung -Bindungsenergie gegen Bindungsenthalpie
Die Bindungsenergie oder Bindungsenthalpie ist die Energiemenge. Es wird unter Verwendung der Bindungsdissoziationsenergiewerte chemischer Bindungen berechnet. Daher ist die Bindungsenergie der Durchschnittswert von Bindungsdissoziationsenergien. Es ist immer ein positiver Wert, da die Bindungsdissoziation endotherm ist (Bindungsbildung ist exotherm). Es gibt keinen erheblichen Unterschied zwischen Bindungsenergie und Bindungsenthalpie.
Referenz:
1. „Bond -Energien.Chemie -Libretexte, Libretexte, 20. Januar. 2017, hier erhältlich.
2. Helmenstine, Anne Marie. „Was ist Bond -Energie?”Thoughtco, hier erhältlich.
3. „Bindungsenergie.Wikipedia, Wikimedia Foundation, 13. März. 2018, hier erhältlich.


