Unterschied zwischen Borazin und Benzol
Der Schlüsselunterschied Zwischen Borazin und Benzol ist das die Borazin enthält drei Boratome und drei Stickstoffatome in der Ringstruktur, während das Benzol sechs Kohlenstoffatome in der Ringstruktur enthält.
Sowohl Borazin als auch Benzol haben ähnliche Strukturen mit einem sechsgliedrigen Ring, und diese beiden Verbindungen sind isoelektronisch. Das heißt, sowohl Borazin als auch Benzol haben die gleiche Anzahl von Elektronen oder die gleiche elektronische Struktur. Sie haben jedoch völlig unterschiedliche chemische und physikalische Eigenschaften, da die Ringe dieser Verbindungen aus verschiedenen Atomen bestehen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Borazin
3. Was ist Benzol
4. Ähnlichkeiten zwischen Borazin und Benzol
5. Nebenseitiger Vergleich - Borazin gegen Benzol in tabellarischer Form
6. Zusammenfassung
Was ist Borazin?
Borazin ist eine anorganische Verbindung mit der chemischen Formel B3H6N3. Es ist eine zyklische Verbindung mit einer sechsgliedrigen Ringstruktur. Das heißt. So können wir seine chemische Formel als (BH "schreiben3) (NH3). Diese Struktur ist auch isoelektronisch mit dem Benzolring. So wie Benzol, ist dies auch eine farblose Flüssigkeit bei Raumtemperatur. Deshalb nennen wir es manchmal als "anorganische Benzol".
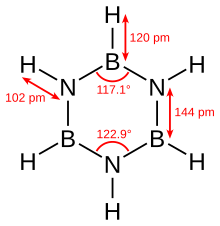
Abbildung 01: Chemische Struktur von Borazin
Darüber hinaus beträgt die Molmasse von Borazin 80.50 g/mol. Der Schmelzpunkt und die Siedepunkte betragen –58 ° C bzw. 53 ° C. Außerdem hat es einen aromatischen Geruch. Darüber hinaus ist dies eine synthetische Verbindung, die wir aus Diboran und Ammoniak im Verhältnis 1: 2 produzieren können.
Die an diesem Prozess verbundene chemische Reaktion ist wie folgt:
3 b2H6 + 6 NH3 → 2 b3H6N3 + 12 h2
Wenn wir vor allem Borazin in Wasser hinzufügen, wird es hydrolysiert, Borsäure, Ammoniak und Wasserstoffgas zu ergeben. Außerdem ist diese Verbindung aufgrund ihres geringen Standards der Enthalpie thermisch sehr stabil; –531 kJ/mol. Auch im Vergleich zu Benzol ist Borazin weitaus reaktiver. Zum Beispiel kann es mit Wasserstoffchlorid reagieren, während Benzol nicht kann.
Nach den röntgenkristallographischen Bestimmungen sind die Bindungslängen in der Ringstruktur von Borazin gleich. Es kann jedoch kein perfektes Sechseck bilden, da das alternierende Muster von Stickstoff und Bor unterschiedliche Bindungswinkel und damit eine unterschiedliche molekulare Symmetrie ergibt.
Was ist Benzol?
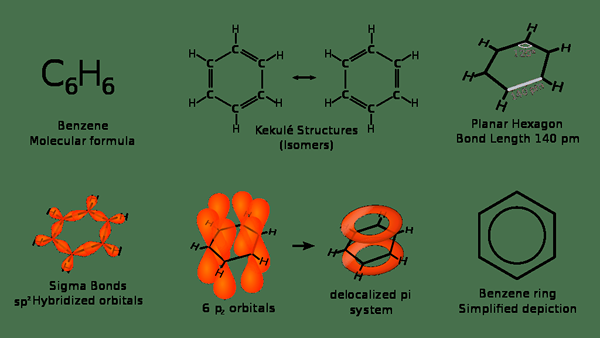
Benzol ist eine organische Verbindung mit der chemischen Formel C6H6. Es hat eine sechsgliedrige Ringstruktur mit allen Mitgliedern, die Kohlenstoffatome sind. Hier ist jedes dieser Kohlenstoffatom an ein Wasserstoffatom gebunden. Da diese Verbindung nur Kohlenstoff- und Wasserstoffatome enthält, ist sie ein Kohlenwasserstoff. Vor allem diese Verbindung tritt natürlich als Bestandteil von Rohöl auf.

Abbildung 02: Verschiedene Darstellungen von Benzol
Wenn Sie sich ihre Eigenschaften ansehen, beträgt die Molmasse von Benzol 78.11 g/mol. Der Schmelzpunkt und die Siedepunkte sind 5.53 ° C und 80.1 ° C jeweils. Außerdem ist es eine farblose Flüssigkeit bei Raumtemperatur. Darüber hinaus ist es ein aromatisches Kohlenwasserstoff. Infolgedessen hat es einen aromatischen Geruch. Darüber hinaus weisen alle Bindungen zwischen den sechs Kohlenstoffatomen ähnliche Längen auf. Daher hat es eine Zwischenstruktur. Wir nennen es eine „Hybridstruktur“. Anschließend ist die tatsächliche Benzolstruktur ein Ergebnis mehrerer Resonanzstrukturen des Benzolmoleküls.
Was sind die Ähnlichkeiten zwischen Borazin und Benzol?
- Beide sind zyklische Strukturen.
- Auch Borazin und Benzol haben einen sechsgliedrigen Ring.
- Darüber hinaus haben beide gleiche Bindungslängen zwischen den Atomen des Rings.
- Darüber hinaus sind beide farblose Flüssigkeiten bei Raumtemperatur.
- Beide sind auch isoelektronisch.
Was ist der Unterschied zwischen Borazin und Benzol?
Borazin ist eine anorganische Verbindung mit der chemischen Formel B3H6N3 Während Benzol eine organische Verbindung mit der chemischen Formel C ist6H6. Daher besteht der Hauptunterschied zwischen Borazin und Benzol darin, dass das Borazin drei Boratome und drei Stickstoffatome in der Ringstruktur enthält, während Benzol sechs Kohlenstoffatome in der Ringstruktur enthält. In Borazin befinden sich die Bor- und Stickstoffatome in einem abwechselnden Muster. Infolgedessen ist das Borazinmolekül kein perfektes Sechseck, aber Benzol hat nur Kohlenstoffatome im Ring. So kann es ein perfektes Sechseck bilden. Daher können wir dies als einen weiteren Unterschied zwischen Borazin und Benzol betrachten.
Vor allem ein signifikanter Unterschied zwischen Borazin und Benzol besteht darin, dass das Borazin eine synthetische Verbindung ist, während das Benzol natürlich in Rohöl als Hauptbestandteil auftritt. Außerdem können wir einen Unterschied zwischen Borazin und Benzol basierend auf ihrer Reaktivität identifizieren. Im Vergleich dazu ist Borazin reaktiver als Benzol.

Zusammenfassung -Borazin gegen Benzol
Borazin und Benzol sind isoelektronisch; was bedeutet, dass sie die gleiche Anzahl von Elektronen oder die gleiche elektronische Struktur haben. Aber es sind zwei verschiedene Verbindungen. Und der Hauptunterschied zwischen Borazin und Benzol besteht darin, dass das Borazin drei Boratome und drei Stickstoffatome in der Ringstruktur enthält, während das Benzol sechs Kohlenstoffatome in der Ringstruktur enthält.
Referenz:
1. MN2555 Folgen. „Borazinstruktur, Vorbereitung und Eigenschaften.”LinkedIn Slideshare, 24. November. 2015. Hier verfügbar
2. "Benzol.Wikipedia, Wikimedia Foundation, 27. September. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Borazin-Dimensionen-2d” von HBF878-eigene Arbeit, (CC0) über Commons Wikimedia
2."Benzol -Darstellungen" von Vladsinger - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


