Differenz zwischen Kalziumchlorid und Natriumchlorid

Der Schlüsselunterschied Zwischen Calciumchlorid und Natriumchlorid ist das Calciumchloridmolekül hat zwei Chloratome, während Natriumchloridmolekül ein Chloratom aufweist. Darüber hinaus ist Calciumchlorid ein weißes Pulver mit hygroskopischen Eigenschaften, während Natriumchlorid ein farbloser Kristall ist und das reine Natriumchlorid nicht hygroskopisch ist.
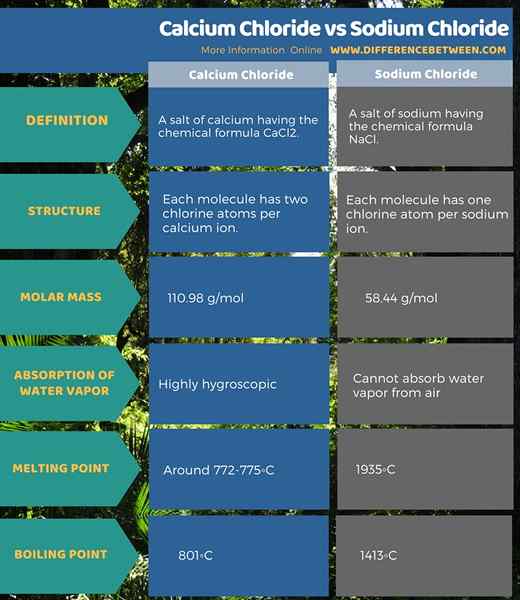
Sowohl Calciumchlorid als auch Natriumchlorid sind anorganische, alkalische Verbindungen. Die chemische Formel von Calciumchlorid ist CaCl2. Die chemische Formel von Natriumchlorid ist NaCl.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Calciumchlorid
3. Was ist Natriumchlorid
4. Seite für Seitenvergleich - Calciumchlorid gegen Natriumchlorid in tabellarischer Form
5. Zusammenfassung
Was ist Calciumchlorid?
Calciumchlorid ist CaCl2 mit einer Molmasse von 110.98 g/mol. Es erscheint als weiße feste Verbindung, die hygroskopisch ist. Dies bedeutet, dass es Wasserdampf aus der Luft absorbieren kann, wenn es der Atmosphäre ausgesetzt ist. Diese Verbindung ist geruchlos. Es fällt unter die Kategorie der Salze; Wir nennen es ein Salz aus Kalzium.
Diese Verbindung ist in Wasser sehr löslich. Aufgrund seiner hygroskopischen Natur tritt diese Verbindung üblicherweise als hydratisierter Komplex auf. Die Formel dieses hydratisierten Komplexes ist CACL2.(H2O) x, in dem x = 0, 1, 2, 4 und 6. Diese hydratisierten Verbindungen sind nützlich bei der Enteisungsprozesse und zur Steuerung von Staub. Die wasserfreie Form (in der x = 0) als Nachkommen aufgrund der hygroskopischen Natur wichtig ist.

Abbildung 01: Aussehen von Kalziumchlorid
Der Schmelzpunkt des wasserfreien Calciumchlorids beträgt etwa 772-775 ° C, während der Siedepunkt 1935 ° C beträgt. Wenn wir diese Verbindung in Wasser auflösen, bildet sie einen Hexaaqua -Komplex; [CA (h2Ö)6]2+. Dies wandelt die Kalzium- und Chloridionen in der Lösung in einen „freien“ Zustand um. Wenn wir dieser wässrigen Lösung eine Phosphatquelle hinzufügen.
Was ist Natriumchlorid?
Natriumchlorid ist NaCl mit einer Molmasse von 58.44 g/mol. Bei Raumtemperatur und Druck erscheint diese Verbindung als feste, farblose Kristalle. Es ist geruchlos. In ihrer reinen Form kann diese Verbindung keinen Wasserdampf absorbieren. Daher ist es nicht hygroskopisch.
Natriumchlorid ist auch ein Salz; Wir nennen es ein Natriumsalz. Es gibt ein Chorinatom pro Natriumatome des Moleküls. Dieses Salz ist für den Salzgehalt des Meerwassers verantwortlich. Der Schmelzpunkt ist 801 ° C, während der Siedepunkt 1413 ° C beträgt. In Natriumchloridkristallen ist jedes Natriumkation mit sechs Chloridionen umgeben und umgekehrt. Daher nennen wir das Kristallsystem als Gesichts-zentriertes Kubiksystem.

Abbildung 02: Salzkristalle
Diese Verbindung löst sich in hohen polaren Verbindungen wie Wasser auf. Dort umgeben Wassermoleküle jedes Kation und Anion. Jedes Ion hat meistens sechs Wassermoleküle um sie herum. Der pH -Wert eines wässrigen Natriumchlorids liegt jedoch aufgrund der schwachen Basizität von Chloridion um den pH7. Wir sagen, es gibt keinen Einfluss von Natriumchlorid auf den pH -Wert einer Lösung.
Was ist der Unterschied zwischen Kalziumchlorid und Natriumchlorid?
Calciumchlorid ist ein Kalziumsalz mit der chemischen Formel CaCl2 Während Natriumchlorid ein Natriumsalz mit der chemischen Formel NaCl ist. Beide sind Salzverbindungen. Darüber hinaus hat jedes Calciumchloridmolekül zwei Chloratome pro Calciumion, während jedes Natriumchloridmolekül ein Chloratom pro Natriumion aufweist. Außerdem unterscheiden sich ihre Molmassen auch voneinander; Die Molmasse von Calciumchlorid beträgt 110.98 g/mol und die Molmasse von Natriumchlorid 58 beträgt.44 g/mol.
Zusammenfassung -Calciumchlorid gegen Natriumchlorid
Calciumchlorid und Natriumchlorid sind Salzverbindungen, die alkalisch sind. Beide Verbindungen enthalten Chloridionen in ihrer Struktur, jedoch in unterschiedlichen Verhältnissen. Der Schlüsselunterschied zwischen Calciumchlorid und Natriumchlorid besteht darin, dass ein Calciumchloridmolekül zwei Chloratome aufweist.
Referenz:
1. „Calcium -Dichlorid.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank. U.S. Nationalbibliothek für Medizin. Hier verfügbar
2. „Natriumchlorid.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Calciumchlorid CACl2'By Kein maschinelles Lesbarer Autor zur Verfügung gestellt. (CC BY-SA 3.0) über Commons Wikimedia
2.'Halit-Kristalle'By W.J.Pilsak in der deutschen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


