Unterschied zwischen Carboxylsäure und Alkohol

Carboxylsäure gegen Alkohol
Carboxylsäuren und Alkohole sind organische Moleküle mit polaren funktionellen Gruppen. Beide haben die Fähigkeit, Wasserstoffbindungen herzustellen, die ihre physikalischen Eigenschaften wie Siedepunkte beeinflussen.
Carboxylsäure
Carboxylsäuren sind die organischen Verbindungen mit der funktionellen Gruppe -Cooh. Diese Gruppe ist als Carboxylgruppe bekannt. Carboxylsäure hat eine allgemeine Formel wie folgt.
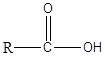
In der einfachsten Art von Carboxylsäure entspricht die R -Gruppe H. Diese Carbonsäure ist als Ameisensäure bekannt. Außerdem kann die R -Gruppe eine gerade Kohlenstoffkette, verzweigte Kette, aromatische Gruppe usw. sein. Essigsäure, Hexansäure und Benzoesäure sind einige der Beispiele für Carboxylsäuren. In der IUPAC -Nomenklatur werden Carboxsäuren benannt, indem das Finale fallengelassen wird -e des Namens des Alkans, der der längsten Kette in der Säure und durch Zugabe entspricht -Oinsäure. Immer wird dem Carboxylcarbon Nummer 1 zugewiesen. Carbonsäuren sind polare Moleküle. Wegen der Gruppe -OH -Gruppe können sie starke Wasserstoffbrückenbindungen miteinander und mit Wasser bilden. Infolgedessen haben Carboxsäuren hohe Siedepunkte. Darüber hinaus lösen sich Carbonsäuren mit niedrigeren Molekulargewichten leicht in Wasser auf. Mit zunehmender Länge der Kohlenstoffkette nimmt die Löslichkeit jedoch ab. Carbonsäuren haben eine Säure von PKA 4-5. Da sie sauer sind, reagieren sie leicht mit Naoh und Nahco3 Lösungen zur Bildung löslicher Natriumsalze. Carboxylsäuren wie Essigsäure sind schwache Säuren, und sie existieren im Gleichgewicht mit seiner konjugierten Base in wässrigen Medien. Wenn die Carboxsäuren jedoch Elektronenentlebungsgruppen wie CL, F haben, sind sie sauer als die nicht substituierte Säure.
Alkohol
Das Merkmal der Alkoholfamilie ist das Vorhandensein einer funktionellen Gruppe (Hydroxylgruppe). Normalerweise ist diese Gruppe an einem SP verbunden3 Hybridisierter Kohlenstoff. Das einfachste Familienmitglied ist Methylalkohol, das auch als Methanol bekannt ist. Alkohole können in drei Gruppen als primär, sekundär und tertiär eingeteilt werden. Diese Klassifizierung basiert auf dem Substitutionsgrad des Kohlenstoffs, an den die Hydroxylgruppe direkt angebracht ist. Wenn der Kohlenstoff nur einen weiteren Kohlenstoff hat, wird der Kohlenstoff als primärer Kohlenstoff und Alkohol ein primärer Alkohol ist. Wenn der Kohlenstoff mit der Hydroxylgruppe an zwei andere Kohlenstoffe gebunden ist, dann ist das ein sekundärer Alkohol und so weiter. Alkohole werden mit einem Suffix benannt -ol Nach der IUPAC -Nomenklatur. Erstens sollte die längste kontinuierliche Kohlenstoffkette, an die die Hydroxylgruppe direkt angebracht ist, ausgewählt werden. Dann wird der Name des entsprechenden Alkans geändert, indem das Finale fallengelassen wird e und das Suffix hinzufügen ol.
Alkohole haben einen höheren Siedepunkt als die entsprechenden Kohlenwasserstoffe oder Ether. Der Grund dafür ist das Vorhandensein einer intermolekularen Wechselwirkung zwischen Alkoholmolekülen durch Wasserstoffbrückenbindung. Wenn die R -Gruppe klein ist, sind Alkohole mit Wasser mischbar, aber da die R -Gruppe größer wird, ist sie tendenziell hydrophob. Alkohole sind polar. Die C-O-Bindung und O-H-Bindungen tragen zur Polarität des Moleküls bei. Die Polarisation der O-H-Bindung macht den Wasserstoff teilweise positiv und erklärt die Säure von Alkoholen. Alkohole sind schwache Säuren, und die Säure liegt nahe an dem von Wasser. -Oh, ist eine schlechte Gruppe, denn oh- ist eine starke Basis.
| Was ist der Unterschied zwischen Carboxylsäure und Alkohol? • Die funktionelle Gruppe von Carboxylsäure ist -cooh und in Alkohol ist es -OH -oh. • Wenn sich beide Gruppen in einem Molekül befinden, wird der Carboxylsäure in der Nomenklatur Priorität gegeben. • Carbonsäuren haben im Vergleich zu entsprechenden Alkoholen eine höhere Säure. • Carboxylgruppe und die -OH -Gruppe liefert charakteristische Peaks in IR- und NMR -Spektren. |


