Unterschied zwischen Katalysator und Reagenz
Der Schlüsselunterschied Zwischen Katalysator und Reagenz ist das Katalysatoren werden während der chemischen Reaktion nicht konsumiert, während Reagenzien während einer chemischen Reaktion konsumiert werden können oder können.
Katalysator und Regent sind zwei wichtige Begriffe, die wir häufig in der analytischen Chemie verwenden, um chemische Reaktionen zu beschreiben. Einige Leute verwenden auch die beiden Begriffe Reagenzien und Reaktanten austauschbar, obwohl es einen kleinen Unterschied zwischen ihnen gibt. Der Katalysator ist ein Substanz, der die Reaktionsgeschwindigkeit einer bestimmten chemischen Reaktion erhöhen kann, während Reagenz ein Substanz oder ein Gemisch zur Verwendung in der chemischen Analyse oder anderen Reaktionen ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein Katalysator
3. Was ist ein Reagenz
4. Seite an Seitenvergleich - Katalysator gegen Reagenz in tabellarischer Form
5. Zusammenfassung
Was ist ein Katalysator?
Katalysator ist eine Substanz, die die Reaktionsgeschwindigkeit einer bestimmten chemischen Reaktion erhöhen kann. Der Prozess der Erhöhung der Reaktionsgeschwindigkeit ist „Katalyse“. Die spezifischste Eigenschaft eines Katalysators ist, dass die chemische Reaktion die Katalysatoren während des Fortschreitens der Reaktion nicht verbraucht. Diese Substanz nimmt jedoch direkt an der Reaktion teil. Daher recycelt diese Substanz, und wir können sie vom Reaktionsgemisch trennen, um es in einer anderen Reaktion zu verwenden. Darüber hinaus brauchen wir nur eine kleine Menge des Katalysators für die Katalyse einer chemischen Reaktion.
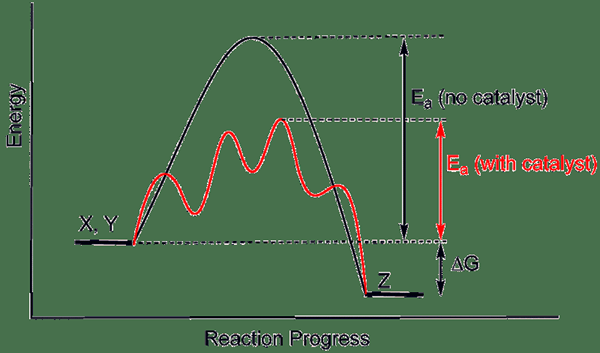
Im Allgemeinen treten chemische Reaktionen schneller auf, wenn ein Katalysator vorliegt. Dies liegt daran. Der alternative Weg hat immer eine niedrige Aktivierungsenergie als der übliche Weg (der in Abwesenheit eines Katalysators auftritt). Darüber hinaus neigt Catalyst dazu, ein Intermediat mit dem Reaktanten zu bilden, und es regeneriert sich später wieder. Wenn eine Substanz die Reaktionsgeschwindigkeit verringert, nennen wir dagegen einen Inhibitor.

Abbildung 01: Ein Diagramm, das zeigt, wie ein Katalysator die Aktivierungsenergie einer Reaktion senkt
Wir können Katalysatoren entweder als homogene oder heterogene Katalysatoren klassifizieren. Wenn es homogen ist, bedeutet dies, dass sich der Katalysator und die Reaktanten in derselben Phase der Materie befinden (i.e. Flüssigphase). Andererseits ist es ein heterogener Katalysator, wenn sich der Katalysator in einer anderen Phase als die der Reaktanten befindet. Hier adsorbierten gasförmige Reaktanten an eine feste Katalysatoroberfläche.
Was ist ein Reagenz?
Ein Reagenz ist eine Substanz oder Mischung zur Verwendung in der chemischen Analyse oder in anderen Reaktionen. Es kann entweder ein Katalysator sein, der die Reaktionsgeschwindigkeit oder ein Reaktant erhöht, der während der Reaktion verbraucht wird.

Abbildung 02: Schwefel ist ein Ausgangsmaterial für verschiedene Synthesereaktionen; Somit ist es ein Reagenz
Wenn nicht, kann es in keiner Weise eine chemische Reaktion beinhalten. Zum Beispiel können Lösungsmittel wie Wasser nur das Medium für eine chemische Reaktion sein, jedoch nicht für einen Reaktanten, der während einer chemischen Reaktion oder eines Katalysators, der die Reaktionsrate erhöht. Darüber hinaus sind Reagenzien entweder Verbindungen oder Gemische.
Was ist der Unterschied zwischen Katalysator und Reagenz?
Der Katalysator ist ein Substanz, der die Reaktionsgeschwindigkeit einer bestimmten chemischen Reaktion erhöhen kann, während Reagenz ein Substanz oder ein Gemisch zur Verwendung in der chemischen Analyse oder anderen Reaktionen ist. Der wichtigste Unterschied zwischen Katalysator und Reagenz besteht darin.
Darüber hinaus besteht ein weiterer Unterschied zwischen Katalysator und Reagenz darin, dass sich die Katalysatoren nach Abschluss der chemischen Reaktion regenerieren, während Reagenzien möglicherweise regeneriert werden oder nicht. Einige Beispiele für Katalysatoren sind Eisen, der ein Katalysator für die Ammoniaksynthese ist, Zeolith ist ein Katalysator für die Racke von Erdöl usw. Beispiele für Reagenzien sind Grignard -Reagenz, Tollens Reagenz, Fehings Reagenz usw.
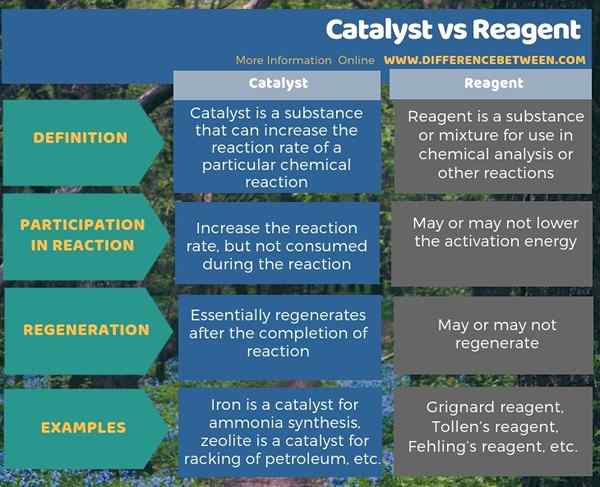
Zusammenfassung -Katalysator gegen Reagenz
Ein Katalysator ist eine Substanz, die die Reaktionsgeschwindigkeit einer bestimmten chemischen Reaktion erhöhen kann, während ein Reagenz eine Substanz oder Mischung zur Verwendung in der chemischen Analyse oder anderen Reaktionen ist. Der wichtigste Unterschied zwischen Katalysator und Reagenz besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Reagenzdefinition und Beispiele.Denkweise Mai. 8, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "KatalyseScheme" von Smokefoot angenommen. Eigene Arbeit angenommen (basierend auf Urheberrechtsansprüchen) (öffentlich zugänglich) über Commons Wikimedia
2. "Sulfer1" von Frau Pugliano (CC BY-SA 2.0) über Flickr


