Unterschied zwischen katalytischen und stöchiometrischen Reagenzien

Der Schlüsselunterschied Zwischen katalytischen und stöchiometrischen Reagenzien ist das Katalytische Reagenzien werden während der Reaktion nicht verbraucht, während stöchiometrische Reagenzien während der Reaktion verbraucht werden.
Katalytische Reagenzien und stöchiometrische Reagenzien sind zwei Arten von Reaktanten in einer bestimmten chemischen Reaktion. Katalytische Reagenzien sind stöchiometrischen Reagenzien überlegen. Dies liegt daran, dass die chemischen Produkte einer bestimmten chemischen Reaktion so ausgelegt werden sollten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind katalytische Reagenzien
3. Was sind stöchiometrische Reagenzien
4. Seite für Seitenvergleich - katalytische gegen stöchiometrische Reagenzien in tabellarischer Form
5. Zusammenfassung
Was sind katalytische Reagenzien?
Katalytische Reagenzien sind Reaktanten in bestimmten chemischen Reaktionen, die während der Reaktion nicht konsumiert werden. Katalysator ist eine Substanz, die die Reaktionsgeschwindigkeit einer bestimmten chemischen Reaktion erhöhen kann. Der Prozess der Erhöhung der Reaktionsgeschwindigkeit ist „Katalyse“. Die spezifischste Eigenschaft eines Katalysators ist, dass die chemische Reaktion die Katalysatoren während des Fortschreitens der Reaktion nicht verbraucht. Diese Substanz nimmt jedoch direkt an der Reaktion teil. Daher recycelt diese Substanz, und wir können sie vom Reaktionsgemisch trennen, um es für eine andere Reaktion zu verwenden. Darüber hinaus brauchen wir nur eine kleine Menge des Katalysators für die Katalyse einer chemischen Reaktion.
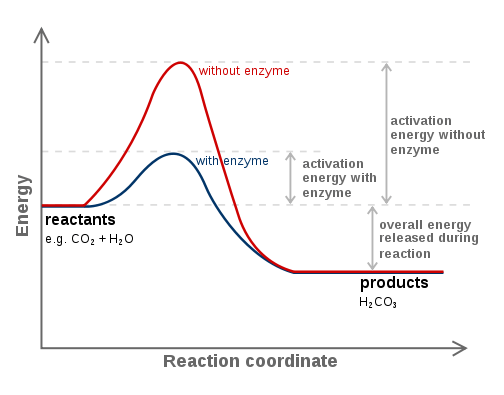
Abbildung 01: Enzyme sind Biokatalysatoren
Im Allgemeinen treten chemische Reaktionen schneller auf, wenn ein Katalysator vorliegt. Es liegt daran, dass ein Katalysator einen alternativen Weg für die Reaktion ermöglichen kann. Der alternative Weg hat immer eine geringe Aktivierungsenergie als der übliche Weg (der in Abwesenheit eines Katalysators auftritt). Darüber hinaus neigt Catalyst dazu, ein Intermediat mit dem Reaktanten zu bilden, und es regeneriert sich später wieder. Wenn jedoch eine Substanz die Reaktionsgeschwindigkeit verringert, nennen wir sie einen Inhibitor.
Wir können Katalysatoren entweder als homogene oder heterogene Katalysatoren klassifizieren. Wenn es homogen ist, bedeutet dies, dass sich der Katalysator und die Reaktanten in derselben Phase der Materie befinden (i.e., Flüssigphase). Andererseits ist es ein heterogener Katalysator, wenn sich der Katalysator in einer anderen Phase als die der Reaktanten befindet. Hier adsorbierten gasförmige Reaktanten an eine feste Katalysatoroberfläche.
Was sind stöchiometrische Reagenzien?
Stöchiometrische Reagenzien sind Reaktanten in einer chemischen Reaktion, die während der Reaktion verbraucht werden. Daher beteiligt sich ein stöchiometrisches Reagenzie aktiv an der chemischen Reaktion. Aufgrund dieses Verbrauchs regeneriert das stöchiometrische Reagenz nach Abschluss der Reaktion nicht.

Abbildung 02: verschiedene Reagenzien
Darüber hinaus unterscheidet sich diese Art von Reagenzien von katalytischen Reagenzien, da sie die Reaktionsgeschwindigkeit nicht erhöhen (keine Auswirkung auf die Aktivierungsenergie).
Was ist der Unterschied zwischen katalytischen und stöchiometrischen Reagenzien?
Der Hauptunterschied zwischen katalytischen und stöchiometrischen Reagenzien besteht darin, dass katalytische Reagenzien während der Reaktion nicht verbraucht werden, während während der Reaktion stöchiometrische Reagenzien verbraucht werden. Daher sind katalytische Reagenzien den stöchiometrischen Reagenzien überlegen. Darüber hinaus können katalytische Reagenzien die Aktivierungsenergiebarriere einer chemischen Reaktion verringern, während stöchiometrische Reagenzien die Aktivierungsenergie nicht beeinflussen können.
Die folgende Tabelle fasst den Unterschied zwischen katalytischen und stöchiometrischen Reagenzien zusammen.

Zusammenfassung -katalytische gegen stöchiometrische Reagenzien
Katalytische Reagenzien und stöchiometrische Reagenzien sind zwei Arten von Reaktanten in einer bestimmten chemischen Reaktion. Der Hauptunterschied zwischen katalytischen und stöchiometrischen Reagenzien besteht darin, dass katalytische Reagenzien während der Reaktion nicht verbraucht werden, während während der Reaktion stöchiometrische Reagenzien verbraucht werden. Daher sind katalytische Reagenzien den stöchiometrischen Reagenzien überlegen.
Referenz:
1. „Stoichiometrie.” Wikipedia, Wikimedia Foundation, 18. Februar. 2020, hier erhältlich.
2. Helmenstine, Anne Marie. „Reagenzdefinition und Beispiele.Denkweise Mai. 8, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Carbonicanhydrase -Reaktion im Gewebe" von fvasconcellos (talk · beiträgt) - Bild: Aktivierung2 Aktualisiert.SVG (CC BY-SA 3.0) über Commons Wikimedia
2. "Grammfärbungsreagenzien in der Reihenfolge Wasserwäsche von jeweils" von Niels Olson (CC BY-SA 2.0) über Flickr


