Differenz zwischen chemischem Gleichgewicht und dynamisches Gleichgewicht
Der Schlüsselunterschied Zwischen dem chemischen Gleichgewicht und dem dynamischen Gleichgewicht ist das, dass die Chemisches Gleichgewicht beschreibt den Zustand, in dem Konzentrationen von Reaktanten und Produkten keine Veränderung unterzogen werden, während das dynamische Gleichgewicht den Zustand beschreibt, in dem sich das Verhältnis von Reaktanten und Produkten nicht ändert, sich die Substanzen jedoch mit gleicher Geschwindigkeit zwischen den Chemikalien bewegen.
Wenn ein oder mehrere Reaktanten in Produkte umgewandelt werden, können sie unterschiedliche Modifikationen und Energieveränderungen durchlaufen. Die chemischen Bindungen in den Reaktanten brechen, und es bilden sich neue Bindungen, um Produkte zu erzeugen, die sich völlig von den Reaktanten unterscheiden. Wir nennen diese Art der chemischen Modifikation als chemische Reaktion. Die Thermodynamik ist die Untersuchung von Energieveränderungen, die sich mit der Energetischen und der Position des Gleichgewichts in einer Reaktion befassen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist chemisches Gleichgewicht
3. Was ist dynamisches Gleichgewicht
4. Seite für Seitenvergleich - Chemisches Gleichgewicht gegen dynamisches Gleichgewicht in tabellarischer Form
6. Zusammenfassung
Was ist chemisches Gleichgewicht?
Chemisches Gleichgewicht ist der Zustand, in dem sowohl Reaktanten als auch Produkte in Konzentrationen vorhanden sind, die keine weitere Tendenz zur Veränderung der Zeit haben. Einige Reaktionen sind reversibel und einige Reaktionen sind irreversibel. In einer Reaktion wandeln sich Reaktanten in Produkte um. Und bei einigen Reaktionen erzeugen die Reaktanten erneut aus den Produkten. Daher ist diese Art von Reaktion reversibel.
Bei irreversiblen Reaktionen regenerieren sie nach der Umwandlung der Reaktanten in Produkte nicht wieder von den Produkten. In einer reversiblen Reaktion, wenn Reaktanten zu Produkten gehen, nennen wir es die Vorwärtsreaktion, und wenn Produkte zu Reaktanten werden, ist es die Rückwärtsreaktion.

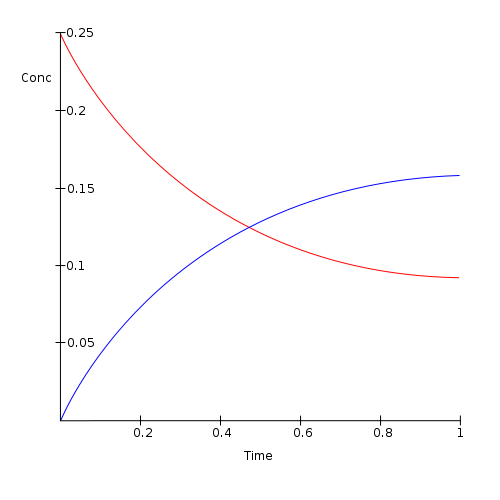
Abbildung 01: Menge der Reaktanten (in Rot) Abnahme und Produktmenge (in blau) nach dem chemischen Gleichgewicht erhöhen
Art der Reaktion
Wenn die Rate der Vorwärts- und Rückwärtsreaktionen gleich ist, liegt die Reaktion im Gleichgewicht auf. Daher ändert sich die Anzahl der Reaktanten und Produkte in gewissem Zeitpunkt nicht. Reversible Reaktionen neigen immer dazu, zum Gleichgewicht zu kommen und dieses Gleichgewicht zu behalten. Wenn sich das System im Gleichgewicht befindet, sind die Produktmenge und die Reaktanten nicht unbedingt gleich. Es kann eine höhere Menge an Reaktanten geben als die Produkte oder umgekehrt. Die einzige Anforderung in einer Gleichgewichtsgleichung besteht darin, eine konstante Menge von beiden über die Zeit aufrechtzuerhalten. Für eine Reaktion im Gleichgewicht können wir eine Gleichgewichtskonstante definieren; wo es gleich dem Verhältnis zwischen der Produktkonzentration und der Konzentration von Reaktionen ist.
K = [Produkt]N/[Reaktant]M
Wo, N und M sind die stöchiometrischen Koeffizienten des Produkts und des Reaktanten. Bei einer Gleichgewichtsreaktion ist die Rückwärtsreaktion, wenn die Vorwärtsreaktion exotherm ist, endotherm und umgekehrt. Normalerweise sind alle anderen Parameter für Vorwärts- und Rückwärtsreaktionen wie diese entgegengesetzt. Wenn wir also eine der Reaktionen erleichtern wollen, müssen wir einfach die Parameter einstellen, um diese Reaktion zu erleichtern.
Was ist dynamisches Gleichgewicht?
Dynamisches Gleichgewicht ist auch eine Art von Gleichgewicht, bei der sich die Produktmengen und Reaktanten im Laufe der Zeit nicht ändern. Im dynamischen Gleichgewicht bedeutet jedoch, dass sich die Mengen nicht ändern, dass die Reaktion gestoppt ist. Vielmehr geht die Reaktion so weiter, dass sie die Mengen unverändert hält (die Nettoänderung ist Null).
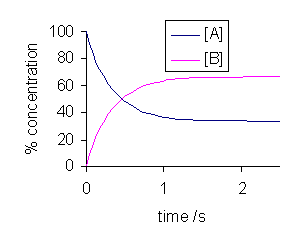
Abbildung 02: Änderung der Vorwärts- und Rückwärtsreaktionen in einem dynamischen Gleichgewicht
Einfach das Wort „dynamisches Gleichgewicht“ bedeutet, dass die Reaktion reversibel ist und fortgesetzt wird. Damit ein dynamisches Gleichgewicht stattfinden kann, sollte das System geschlossen sein, so dass keine Energie oder Materie aus dem System entkommt.
Was ist der Unterschied zwischen dem chemischen Gleichgewicht und dem dynamischen Gleichgewicht?
Dynamisches Gleichgewicht ist eine Art chemischer Gleichgewicht. Der Schlüsselunterschied zwischen chemischem Gleichgewicht und dynamischem Gleichgewicht besteht darin zwischen den Chemikalien mit gleicher Geschwindigkeit.
Darüber hinaus wird in einem dynamischen Gleichgewicht die Reaktion fortgesetzt, aber die Menge an Reaktanten und Produkten bleibt unverändert, da die Raten der Vorwärts- und Rückwärtsreaktionen gleich sind. Es kann einige Fälle im chemischen Gleichgewicht geben, in denen die Produktmengen und Reaktanten unverändert bleiben, da die Reaktion gestoppt ist. Dies ist also auch ein Unterschied zwischen dem chemischen Gleichgewicht und dem dynamischen Gleichgewicht.
Nach der Infografik über den Unterschied zwischen chemischem Gleichgewicht und dynamischem Gleichgewicht liefert mehr Informationen zu diesen Unterschieden.

Zusammenfassung -Chemisches Gleichgewicht gegen dynamisches Gleichgewicht
Ein Gleichgewicht ist ein Zustand eines Systems, das keine Nettoänderung zeigt. Das chemische Gleichgewicht erhält diesen Zustand, wenn die Reaktion stoppt, während das dynamische Gleichgewicht diesen Zustand erhält, wenn die Vorwärts- und Rückwärtsreaktionsraten gleich sind. Der Schlüsselunterschied zwischen chemischem Gleichgewicht und dynamischem Gleichgewicht besteht darin bewegen.
Referenz:
1. „Chemisches Gleichgewicht - Typen, Prinzipien und Gesetze der Gleichgewichte.TOPPR BYTES, TOPPR.com, 16. März. 2018. Hier verfügbar
"Dynamisches Gleichgewicht.Wikipedia, Wikimedia Foundation, 17. Dezember. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”ChemicalEquilibrium” von Fintelelia - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia
2."Dynamisches Gleichgewicht" von Petergans bei English Wikipedia - eigene Arbeit (Public Domain) über Commons Wikimedia


