Unterschied zwischen Konjugatsäure und Konjugatbase
Der Schlüsselunterschied Zwischen Konjugatsäure und konjugierter Base ist das Konjugatsäuren spenden Protonen, während Konjugatbasen Protonen akzeptieren.
Im Jahr 1923 präsentierten zwei Wissenschaftler, Bronsted und Lowry. Laut Bronsted - Lowry Theory ist eine Säure ein Protonenspender, und eine Basis ist ein Protonenakzeptor. Daher sollte ein Molekül, das sich als Säure verhalten kann, auf einen Protonenakzeptor stoßen. Andererseits sollte ein Molekül, das sich als Basis verhalten kann, auf einen Protonspender stoßen. Daher sollten sowohl Protonenspender als auch Akzeptoren für eine Säure-Base-Reaktion dort sein. Wasser kann jedoch sowohl als Säure als auch als Basis wirken. Wenn Wasser ein Proton akzeptiert, bildet es ein Hydroniumion und wenn es ein Proton spendet, erzeugt es ein Hydroxidionen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist konjugierte Säure
3. Was ist konjugierte Basis
4. Seite für Seitenvergleich - Konjugatsäure gegen Konjugatbase in tabellarischer Form
5. Zusammenfassung
Was ist konjugierte Säure?
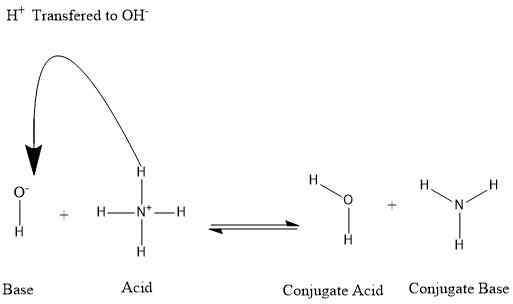
Konjugatsäure ist eine Substanz aus einer Base. Wenn eine Base ein Proton aus einem anderen Molekül akzeptiert, bildet sie eine Konjugat -Säure. Konjugatsäure kann das Elektron entfernen und zur Elternbasis zurückkehren. Daher haben Konjugatsäuren saure Eigenschaften.

Abbildung 01: Bildung von Konjugatsäure und Konjugatbase
Zum Beispiel können wir die Situation betrachten, in der sich Ammoniak in Wasser auflöst.
NH3+ H2O ⇌ nh4+ + OH-
Im obigen Beispiel ist Ammoniumion die Konjugatsäure von Ammoniak. Ebenso ist Wasser die Konjugatsäure der Hydroxidbase, wenn die Rückwärtsreaktion berücksichtigt wird.
Was ist konjugierte Basis?
Die Konjugatbase ist eine Substanz, die sich nach einer Säure bildet. Dies kann jedoch wieder einen Proton akzeptieren; So hat es grundlegende Eigenschaften. Der aus der Elternsäure gebildete potenzielle Protonenakzeptor ist die konjugierte Base. Wenn die konjugierte Base ein Proton akzeptiert, ist es wieder umgekehrt zur Elternsäure umgekehrt.
Außerdem können viele Lösungsmittel als Protonenspender oder Akzeptoren fungieren. Daher können sie das saure oder grundlegende Verhalten in gelösten Stoffen induzieren. Zum Beispiel, wenn sich Ammoniak in Wasser auflöst. In der Zwischenzeit wird das Wassermolekül in einen Hydroxidanion umgewandelt. Hier ist die konjugierte Basis des Wassers der Hydroxidanion. Und die konjugierte Basis des Ammoniums ist Ammoniak.
Was ist der Unterschied zwischen Konjugatsäure und Konjugatbase?
Der Schlüsselunterschied zwischen Konjugatsäure und Konjugatbase besteht darin, dass Konjugatsäuren Protonen spenden können, während Konjugatbasen Protonen akzeptieren können. Darüber hinaus werden Konjugatsäuren aus Basen gebildet; Umgekehrt werden konjugierte Basen aus Säuren gebildet. Die Konjugat -Säuren und -Basen, die sich in einer spontanen Reaktion bilden, sind jedoch viel schwächer als ihre Elternmoleküle.

Zusammenfassung -Konjugatsäure gegen Konjugatbase
Konjugatsäure und Konjugatbase sind ein Paar chemischer Spezies mit entgegengesetzten chemischen Verhalten. Der Schlüsselunterschied zwischen Konjugatsäure und Konjugatbase besteht darin, dass Konjugatsäuren Protonen spenden können, während Konjugatbasen Protonen akzeptieren können.
Referenz:
1. Libretexten. „11.12: Konjugate-Säure-Base-Paare.”Chemistry Libretexten, National Science Foundation, 26. November. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Konjugat-Basenreaktion” von Schlenk (CC BY-SA 3.0) über Commons Wikimedia


