Differenz zwischen Koordinationsverbindung und organometallischer Verbindung
Schlüsselunterschied - Koordinationsverbindung vs organometallische Verbindung
Koordinationsverbindungen und organometallische Verbindungen sind komplexe Verbindungen. Der Schlüsselunterschied zwischen der Koordinationsverbindung und der organometallischen Verbindung ist das Koordinationsverbindungen enthalten kovalente Bindungen, während organometallische Verbindungen Metall-Kohlenstoff-Bindungen enthalten.
Koordinationsverbindungen sind komplexe Verbindungen, die aus einem Metallionen bestehen, das von Molekülen oder Ionen umgeben ist, die reich an Elektronen sind. Diese umgebenden Komponenten sind als Liganden bekannt. Organometallische Verbindungen sind komplexe Verbindungen, in denen kovalente Metall-Kohlenstoff-Bindungen existieren. Wenn es mindestens eine Metall-Kohlenstoff-Bindung gibt, gilt diese Verbindung als eingehende Verbindung.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Koordinationsverbindung
3. Was ist eine organometallische Verbindung
4. Beziehung zwischen Koordinationsverbindung und organometallischer Verbindung
5. Seite an Seitenvergleich - Koordinationsverbindung gegen organometallische Verbindung in tabellarischer Form
6. Zusammenfassung
Was ist Koordinationsverbindung?
Koordinationsverbindungen sind komplexe Verbindungen, die zentrale Metallatome oder Ionen enthalten, die von elektronenreichen Molekülen oder Ionen umgeben sind, die als Liganden bezeichnet werden. Diese Liganden sind über koordinierte kovalente Bindungen an das Metallatom (oder Ion) gebunden. Eine Koordinatenkovalentbindung wird gebildet, wenn einzelne Elektronenpaare eines Liganden an leere D -Orbitale eines Metallatoms oder Metallions gespendet werden. In den meisten Fällen werden Übergangsmetallatome dieser Art von Verbundbildung unterzogen, da diese Atome reich an leeren D -Atomorbitalen sind.
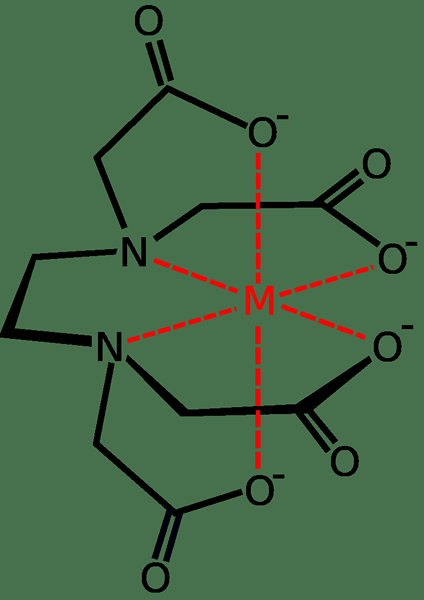
Abbildung 01: Ein Metall-EDTA-Komplex ist eine Koordinationsverbindung
Koordinationsverbindungen können neutral sein (CO (NH)3) Cl3) positiv geladen ([ND (h)2Ö)9]3) oder negativ geladen ([UF8]4). Die geladenen Koordinationsverbindungen sind auch als komplexe Ionen bekannt. Verschiedene Koordinationskomplexe haben unterschiedliche Strukturen, die als Geometrien bekannt sind. Die Geometrie einer Koordinationsverbindung wird durch die Koordinationszahl des Komplexes bestimmt. Die Koordinationsnummer ist die Anzahl der Liganden, die mit dem zentralen Metallatom oder Ion verbunden sind.
- Koordinationszahl = 2 ist die lineare Geometrie
- Koordinationsnummer = 3 ist die trigonale planare Geometrie
- Koordinationszahl = 4 ist die tetraedrische oder quadratische planare Geometrie
- Koordinationszahl = 5 ist die trigonale bipyramidale Geometrie
- Koordinationszahl = 6 ist die oktaedrische Geometrie
- Koordinationszahl = 7 ist die pentagonale bipyramidale Geometrie
- Koordinationszahl = 8 ist die quadratische antiprismatische Geometrie
Was ist eine organometallische Verbindung?
Organometallische Verbindungen sind komplexe Verbindungen, in denen kovalente Metall-Kohlenstoff-Bindungen existieren. Diese Verbindungen haben kovalente Bindungen zwischen Kohlenstoffatomen und Metallatomen. Es gibt jedoch auch einige Ausnahmen; Metall-Cyano-Bindungen werden nicht als organometallische Bindungen angesehen. Metallcarbonylkomplexe werden als organometallische Verbindungen angesehen.
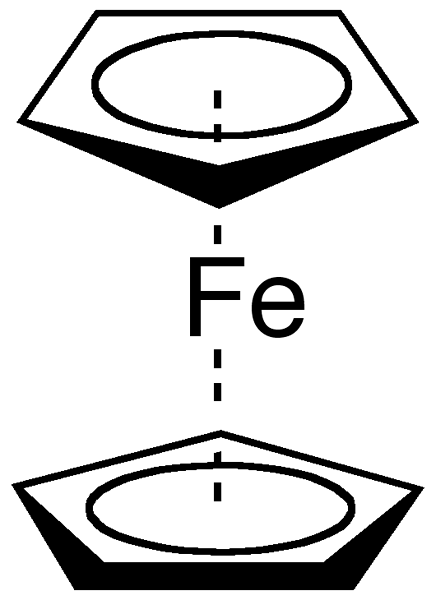
Das Metall, das an der Bildung einer organometallischen chemischen Bindung beteiligt ist. Einige häufige Beispiele für organometallische Verbindungen sind ein Grignard -Reagenz, das entweder Lithium (LI) oder Magnesium (Mg), Ferrocen, Tetracarbonyl -Nickel usw. enthalten. Bor ist ein Metalloid, bildet aber auch organometallische Verbindungen wie Organoboranverbindungen.

Abbildung 02: Ferrocen
Organometallische Verbindungen sind gute Quellen für nukleophile Kohlenstoffatome. Das liegt daran, dass die Elektronegativität des Metalls im Vergleich zu Kohlenstoff sehr niedrig ist. Daher kann das Metallatom leicht ein Kation bilden, indem das Kohlenstoffatom Bindungselektronen verleiht. Jetzt ist das Kohlenstoffatom reich an Elektronen und kann daher als Nucleophil wirken. Dieses Kohlenstoff-Nucleophil kann elektrophile Kohlenstoffatome angreifen und neue Kohlenstoffkohlenstoffbindungen bilden.
Was ist die Beziehung zwischen Koordinationsverbindung und organometallischer Verbindung?
- Einige Koordinationsverbindungen enthalten Metallionen, die von organischen Liganden umgeben sind. Wenn diese Liganden über Heteroatome wie Sauerstoff und Stickstoff an das Metallatom gebunden sind, wird die Verbindung als Koordinationsverbindung angesehen. Wenn es jedoch direkte Bindungen zwischen Kohlenstoffatomen und dem Metallatom gibt, wird es als eingehende Verbindung betrachtet.
Was ist der Unterschied zwischen Koordinationsverbindung und organometallischer Verbindung?
Koordinationsverbindung gegen organometallische Verbindung | |
| Koordinationsverbindungen sind komplexe Verbindungen, die zentrale Metallatome oder Ionen enthalten, die von elektronenreichen Molekülen oder Ionen umgeben sind, die als Liganden bezeichnet werden. | Organometallische Verbindungen sind komplexe Verbindungen, in denen kovalente Metall-Kohlenstoff-Bindungen existieren. |
| Chemische Verbindung | |
| Koordinationsverbindungen enthalten kovalente Bindungen zwischen Metallatomen und Liganden. | Organometallische Verbindungen enthalten mindestens eine kovalente Metall-Kohlenstoff-Bindung. |
| Komponenten | |
| Koordinationsverbindungen enthalten Metallatome oder Ionen und elektronenreiche Liganden. | Organometallische Verbindungen enthalten Metallatome und einen organischen Teil eines Moleküls. |
| Farbe | |
| Fast alle Koordinationsverbindungen sind auf der Grundlage des Oxidationszustands des zentralen Metallatoms sehr farbenfroh. | Organometallische Verbindungen sind nicht im Wesentlichen farbenfroh. |
Zusammenfassung -Koordinierungsverbindung vs organometallische Verbindung
Koordinationsverbindungen sind komplexe Verbindungen aus einem Metallatom oder einem Metallion, das von elektronenreichen Liganden umgeben ist. Diese Liganden werden über kohlenvalische Bindungen an das Metallatom gebunden. Organometallische Verbindungen sind komplexe Verbindungen mit mindestens eine Metall-Kohlenstoff-Bindung. Die Differenz zwischen Koordinationsverbindung und organometallischer Verbindung besteht darin, dass Koordinationsverbindungen koordinate kovalente Bindungen enthalten, während organometallische Verbindungen Metall-Kohlenstoff-Bindungen enthalten.
Referenz:
1.„Koordinationsverbindungen.Chemie -Libretexte, Libretexten, 19. Januar. 2018. Hier verfügbar
2.„Organometallische Chemie.Wikipedia, Wikimedia Foundation, 27. März. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Metal -edta'by Smokefootderivative Arbeit: Chamberlain2007 (Talk) - Medta.PNG (Public Domain) über Commons Wikimedia
2.'Ferrocene-2D'By Der ursprüngliche Uploader war Benjah-BMM27 in English Wikipedia (Public Domain) über Commons Wikimedia


