Unterschied zwischen Kovalenz und Oxidationszustand
Schlüsselunterschied - Kovalenz vs Oxidationszustand
Atome verschiedener chemischer Elemente werden miteinander verbunden und bilden unterschiedliche chemische Verbindungen. Bei der Bildung einer Verbindung werden die Atome über ionische Bindungen oder kovalente Bindungen miteinander verbunden. Kovalenz- und Oxidationszustand sind zwei Begriffe, die den Zustand dieser Atome in den chemischen Verbindungen beschreiben. Kovalenz ist die Anzahl der kovalenten Bindungen, die sich ein Atom bilden kann. Daher hängt die Kovalenz von der Anzahl der Elektronen ab, die Atom mit anderen Atomen teilen kann. Der Oxidationszustand eines Atom. Der Schlüsselunterschied Zwischen Kovalenz- und Oxidationszustand befindet sich die Die Kovalenz eines Atoms ist die Anzahl der kovalenten Bindungen, die sich um Atom bilden können, während der Oxidationszustand eines Atom.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Kovalenz
3. Was ist Oxidationszustand
4. Seite an Seitenvergleich - Kovalenz gegen den Oxidationszustand in tabellarischer Form
5. Zusammenfassung
Was ist Kovalenz?
Kovalenz ist die Anzahl der kovalenten Bindungen, die sich ein Atom mit anderen Atomen bilden kann. Daher wird die Kovalenz durch die Anzahl der Elektronen bestimmt, die im äußersten Orbital eines Atoms vorhanden sind. Die Begriffe Valenz und Kovalenz sollten jedoch nicht verwechselt werden, da sie unterschiedliche Bedeutungen haben. Valenz ist die kombinierende Kraft eines Atoms. Manchmal entspricht die Kovalenz der Valenz. Es passiert jedoch nicht immer.
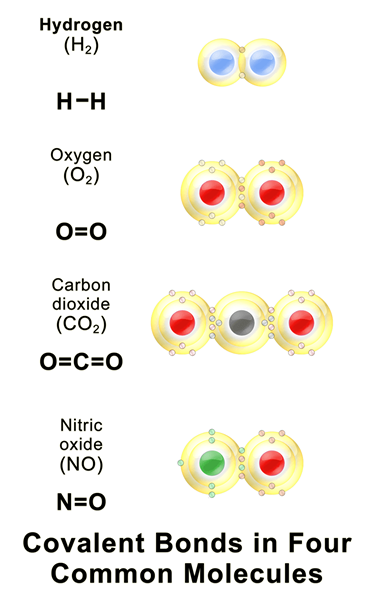
Abbildung 01: Einige häufige kovalente Verbindungen
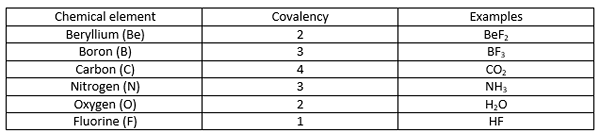
Eine kovalente Bindung ist eine chemische Bindung, die gebildet wird, wenn zwei Atome ihre äußersten ungepaarten Elektronen teilen, um die Elektronenkonfiguration zu vervollständigen. Wenn ein Atom unvollständige Elektronenschalen oder Orbitale hat, wird dieses Atom reaktiver, da die unvollständigen Elektronenkonfigurationen instabil sind. Daher haben diese Atome entweder Gewinn-/Lose -Elektronen oder teilen Elektronen, um die Elektronenschalen zu füllen. Die folgende Tabelle zeigt einige Beispiele für chemische Elemente mit unterschiedlichen Kovalenzwerten.
Was ist Oxidationszustand?
Der Oxidationszustand eines Atom. Wenn die Elektronen verloren gehen oder gewonnen werden, wird die elektrische Ladung eines Atoms entsprechend geändert. Elektronen sind negativ geladene subatomare Teilchen, deren Ladung durch die positive Ladung von Protonen in diesem Atom neutralisiert wird. Wenn die Elektronen verloren gehen, erhält das Atom eine positive Ladung, während beim Gewinn von Elektronen ein Atom eine negative Nettoladung erhält. Dies geschieht aufgrund des Ungleichgewichts positiver Ladungen der Protonen im Kern. Diese Ladung kann als Oxidationszustand dieses Atoms angegeben werden.
Der Oxidationszustand eines Atoms wird durch eine ganze Zahl mit dem positiven (+) oder negativen (-) Zeichen bezeichnet. Dieses Zeichen zeigt an, ob das Atom Elektronen gewonnen oder verloren hat. Die gesamte Zahl gibt die Anzahl der Elektronen an, die zwischen Atomen ausgetauscht wurden.
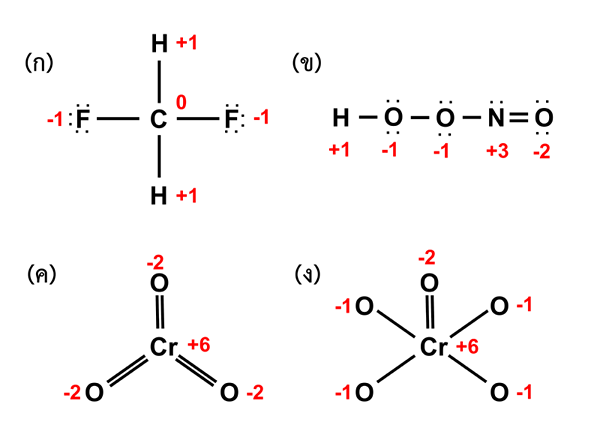
Abbildung 02: Oxidationszustand verschiedener Verbindungen
Bestimmung des Oxidationszustands eines Atoms
Der Oxidationszustand eines bestimmten Atoms kann unter Verwendung der folgenden Regeln bestimmt werden.
- Der Oxidationszustand eines neutralen Elements ist immer Null. EX: Der Oxidationszustand von Natrium (Na) ist Null.
- Die Gesamtladung der Verbindung sollte der Summe der Ladungen jedes in dieser Verbindung vorhandenen Atoms entsprechen. Beispiel: Die Gesamtladung von KCL ist Null. Dann sollten die Gebühren von K und CL +1 und -1 betragen.
- Der Oxidationszustand des Elements der Gruppe 1 beträgt immer +1. Die Elemente der Gruppe 1 sind Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium.
- Der Oxidationszustand der Elemente der Gruppe 2 beträgt immer +2. Die Elemente der Gruppe 2 sind Beryllium, Magnesium, Kalzium, Strontium, Barium und Radium.
- Die negative Ladung wird dem Atom mit einer höheren Elektronegativität als die der anderen damit verbundenen Atome vergeben.
- Der Oxidationszustand von Wasserstoff beträgt immer +1, außer wenn Wasserstoff an ein Metall der Gruppe 1 gebunden ist.
- Der Oxidationszustand des Sauerstoffs beträgt -2, außer wenn es sich in Form von Peroxid oder Superoxid befindet.
Was ist der Unterschied zwischen Kovalenz und Oxidationszustand?
Kovalenz gegen den Oxidationszustand | |
| Kovalenz ist die Anzahl der kovalenten Bindungen, die sich ein Atom mit anderen Atomen bilden kann. | Der Oxidationszustand eines Atom. |
| Elektrische Ladung | |
| Die Kovalenz zeigt nicht die elektrische Ladung eines Atoms an. | Der Oxidationszustand ergibt die elektrische Ladung eines Atoms. |
| Chemische Verbindung | |
| Die Kovalenz gibt die Anzahl der chemischen Bindungen (kovalente Bindungen) an, die ein bestimmtes Atom haben kann. | Der Oxidationszustand enthält keine Details zu den chemischen Bindungen, die von einem Atom gebildet werden. |
| Zustand des Elements | |
| Die Kovalenz eines reinen Elements hängt von der Anzahl der Elektronen ab, die in der äußersten Elektronenhülle eines Atoms dieses Elements vorhanden sind. | Der Oxidationszustand eines reinen Elements ist immer Null. |
Zusammenfassung - Kovalenz vs Oxidationszustand
Kovalenz- und Oxidationszustand von Atomen beschreiben die chemische Natur eines Atoms in einer chemischen Verbindung. Der Unterschied zwischen Kovalenz und Oxidationszustand besteht darin, dass die Kovalenz eines Atoms die Anzahl der kovalenten Bindungen ist, die Atom bilden kann, während der Oxidationszustand eines Atoms die Anzahl der Elektronen ist.
Referenz:
1.„Kovalenz.”Com, Wörterbuch.com. Hier verfügbar
2."Oxidationszustand.Wikipedia, Wikimedia Foundation, 5. März. 2018. Hier verfügbar
3.„Chemiekalenz und molekulare Strukturen.”Com. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Kovalente Bonds'By Bruceblaus - eigene Arbeit, (CC BY -SA 4.0) über Commons Wikimedia
2.'Oxidationszustandsaufträge' von Saranphong Yimklan - eigene Arbeit, (Public Domain) über Commons Wikimedia


