Unterschied zwischen Kupfer und Cupric
Schlüsselunterschied -Cuprous vs CUPRIC
Die stabilen Kationen, die von Kupfer gebildet werden, das ein Blockelement ist, sind kugelförmige Kationen und kupferische Kation. Die kugelhaften und kuprischen Ionen unterscheiden sich aufgrund ihrer elektronischen Konfigurationen voneinander. Der Schlüsselunterschied Zwischen Cuprous und Cupric ist das cuprous ist Kupfer 1+ Kation, während Cupric Kupfer +2 Kation ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist üppig
3. Was ist cupric
4. Ähnlichkeiten zwischen Kupfer und Cupric
5. Seite an Seitenvergleich - Cupro -gegen Cupric in tabellarischer Form
6. Zusammenfassung
Was ist üppig?
Der Name Cuprous wird dem vom Kupferatom gebildeten +1 Kation gegeben. Es wird von Cu bezeichnet+1. Die Elektronenkonfiguration von Kupferatom ist [AR] 3D10 4s1. Wenn sich das Kationen der Kugelkation bildet, ist die Elektronenkonfiguration [AR] 3D10 4s0. Daher wird das kupferische Kation gebildet, wenn ein Elektron aus dem Kupferatom entfernt wird. Da das kupfer Kation nur mit einem Oxidationszustand von -1 mit -1 binden kann Monovalenter Kation. Die Elektronenkonfiguration des Cupro -Kationen ist sehr stabil. Somit gibt es viele Verbindungen, die durch dieses Kation gebildet werden. Einige Beispiele sind unten gezeigt:
- Kupferoxid (Cu2Ö)
- Cupro -Jodid (CUI)
- Cupro -Sulfid (Cu2S)
Die Hydratationsenergie eines Moleküls oder Ions ist die Energiemenge, die freigesetzt wird, wenn ein Mol dieser Verbindung u8ndergo -Hydratation (Auflösung im Wasser) freigesetzt wird.

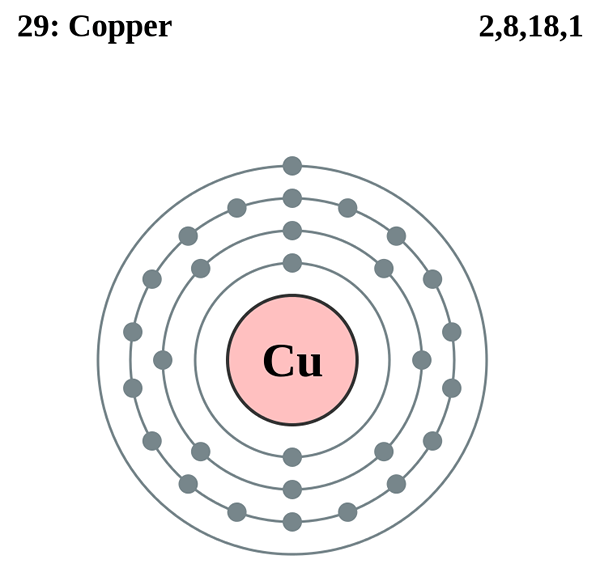
Abbildung 01: Die Atomstruktur von Kupfer
Das kugele Ion hat im Vergleich zum kuprischen Ion eine niedrige Hydratationsenergie, weil das d10 Die Elektronenkonfiguration in einem Problem ist stabil als der D9 Elektronenkonfiguration im Cupric Ion.
Was ist cupric?
Der Name CUPRIC wird dem vom Kupferatom gebildeten +2 Kation gegeben. Es wird von Cu bezeichnet2+. Die Elektronenkonfiguration von Kupferatom ist [AR] 3D10 4s1. Wenn das kuprische Kation gebildet wird, ist die Elektronenkonfiguration [AR] 3D9 4s0. Das kuprische Kation wird gebildet, wenn zwei Elektronen aus einem Kupferatom entfernt werden, wodurch das Atom eine 2+ elektrische Ladung verleiht. Das kuprische Kation kann entweder mit zwei Anionen mit -1 Oxidationszustand oder einem Anion mit -2 Oxidationszustand binden. Daher ist das kuprische Kation ein zweiwertiges Kation. Die mit diesem Kation gebildeten Verbindungen umfassen Followings:
- Cupricoxid (Cuo)
- Cupric Iodid (CUI)
- Cupric -Sulfid (CUS)
Was sind die Ähnlichkeiten zwischen Cuprous und Cupric??
- Sowohl Cuprous als auch Cupric sind Kationen, die aus dem Elektronenverlust aus einem Kupferatom gebildet wurden.
- Beide sind stabile Kationen.
- Beide haben eine positive elektrische Ladung.
- Beide haben die gleiche Atommasse (weil die Masse eines Elektrons vernachlässigbar ist).
Was ist der Unterschied zwischen Cuprous und Cupric?
Cuprous gegen cupric | |
| Der Name Cuprous wird dem vom Kupferatom gebildeten +1 Kation gegeben. | Der Name CUPRIC wird dem vom Kupferatom gebildeten +2 Kation gegeben. |
| Kategorie | |
| UPROUS -Ionen sind einwertige Kationen. | CUPRIC IONEN sind zweifeste Kationen. |
| Elektronenkonfiguration | |
| Die Elektronenkonfiguration von Cuproos Ion ist [ar] 3D10 4s0. | Die Elektronenkonfiguration von Cupric Ion ist [ar] 3D9 4s0. |
| Elektron verlor, um ein Kupferatom zu bilden | |
| Es entsteht das Problem der Kupplungen, wenn ein Elektron aus dem Kupferatom verloren geht. | Es entsteht ein kupferisches Ion, wenn zwei Elektronen aus dem Kupferatom verloren gehen. |
| Stabilität | |
| Die Stabilität des Problems ist aufgrund des d hoch10 Elektronenkonfiguration. | Die Stabilität des Cupric -Ions ist aufgrund des d niedrig9 Elektronenkonfiguration. |
| Bezeichnung | |
| Das Problem wird durch Cu bezeichnet+1. | Das kuprische Ion wird durch Cu bezeichnet2+. |
| Elektrische Ladung | |
| Das Problem hat eine elektrische Ladung von +1. | Das kuprische Ion hat +2 elektrische Ladung. |
| Feuchtigkeitsenergie | |
| Die Hydratationsenergie des Problems ist im Vergleich zum kupischen Ion niedrig. | Die Hydratationsenergie des Kupfen -Ions ist im Vergleich zum Kupferion hoch. |
Zusammenfassung -Cuprous vs CUPRIC
Kupfer Ionen und Kupfen sind Kationen aus Kupferatom aufgrund des Elektronenverlustes. Der Unterschied zwischen Cuprous und Cupric besteht darin.
Referenz:
1. "Kupfer.”Wikipedia, Wikimedia Foundation, 3. April. 2018. Hier verfügbar
2. „CUPRIC KATION.Nationales Zentrum für Biotechnologieinformationen. Pubchem Compound -Datenbank, u.S. Nationalbibliothek für Medizin. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Elektronenschale 029 Kupfer' (CC BY-SA 2.0 uk) über Commons Wikimedia


