Unterschied zwischen Curium 242 und Curium 244
Der Schlüsselunterschied Zwischen Curium 242 und Curium 244 ist das Curium 242 hat 146 Neutronen in seinem Atomkern, während Curium 244 148 Neutronen in seinem Atomkern aufweist.
Curium ist ein chemisches Element mit der Atomzahl 96 und dem chemischen Symbol CM. Es hat eine Reihe von Isotopen, die die gleiche Atomzahl, aber unterschiedliche Massenzahlen haben. Curium 242 und Curium 244 sind zwei solche Isotope des chemischen Elements Curium.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Curium 242
3. Was ist Curium 244
4. Seite an Seite Vergleich - Curium 242 gegen Curium 244 in tabellarischer Form
5. Zusammenfassung
Was ist Curium 242?
Curium 242 ist ein Isotop des Curiums des chemischen Elements. Es hat die Atomzahl 96 und die Massenzahl 242. Das heißt, es gibt 96 Protonen im Atomkern des Curium -Atoms zusammen mit 146 Neutronen. Die Atommasse von Curium 242 beträgt ungefähr 242.0588 Amu. Das chemische Symbol für dieses Isotop ist 242Cm. Es ist ein hoch radioaktives chemisches Element mit einer Halbwertszeit von rund 162 Tagen. Dieses Isotop ist jedoch ein synthetisches Radioisotop, das in der Natur nicht gefunden werden kann. Normalerweise erfolgt der Zerfall dieses chemischen Elements über den Alpha -Zerfall. Es produziert Plutonium-238 nach Alpha-Zerfall.

Abbildung 01: Curium
Das Curium 242 war das allererste Isotop unter allen Isotopen des Curiums, die in einem Labor (1944) produziert werden sollen, (1944). Es wurde hergestellt, indem Plutonium-238 mit Alpha-Partikeln bombardiert wurde, was der entgegengesetzte Prozess des Alpha-Zerfalls dieses Isotops ist. Später wurde das 240-Kurium-Isotop auf die gleiche Weise unter Verwendung von Helium-4 anstelle von Alpha-Partikeln erzeugt. Abgesehen vom Alpha -Zerfall von Curium 242 können wir auch seine spontane Spaltung beobachten.
Was ist Curium 244?
Curium 244 ist ein Isotop von Curium -chemischem Element mit Atomzahl 96 und Massenzahl 244. Das heißt, es gibt 96 Protonen zusammen mit 148 Neutronen im Atomkern des Curium 244 -Atoms. Wir können das Curium 244 Isotop als bezeichnen 244cm. Die Atommasse dieses Isotops beträgt 244.0627 Amu. Darüber hinaus tritt dieses Isotop als radioaktives Element auf. Deshalb können wir es als Radioisotop nennen. Die Halbwertszeit dieses Isotops beträgt ungefähr 18 Jahre, was im Vergleich zu einem 242 Curium-Radioisotop ein sehr hoher Wert ist. Normalerweise neigt es tendenziell radioaktives Zerfall, um Plutonium-240 zu bilden. Hier können wir den Alpha -Zerfall von Curium 244 beobachten. Darüber hinaus ist dies auch ein synthetisches Radioisotop und kann auch spontane Spaltung durchlaufen.
Was ist der Unterschied zwischen Curium 242 und Curium 244?
Curium ist ein chemisches Element mit der Atomzahl 96 und dem chemischen Symbol CM. Curium 242 und Curium 244 sind zwei der vielen radioaktiven Isotope von Curium -chemischem Element. Der Schlüsselunterschied zwischen Curium 242 und Curium 244 besteht darin, dass Curium 242 146 Neutronen in seinem Atomkern aufweist, während Curium 244 148 Neutronen in seinem Atomkern aufweist.
Darüber hinaus ist die Halbwertszeit von Curium 242 im Vergleich zu Curium 244 viel niedriger. Tatsächlich beträgt die Halbwertszeit von Curium 242 etwa 16 Tage, während die Halbwertszeit von Curium 244 etwa 18 Jahre beträgt.
Die folgende Infografik fasst den Unterschied zwischen Curium 242 und Curium 244 zusammen.
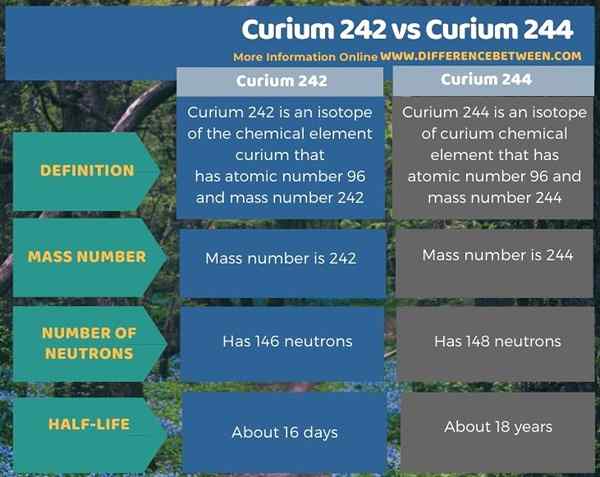
Zusammenfassung -Curium 242 vs Curium 244
Curium ist ein chemisches Element mit Atomzahl 96 und chemischem Symbol CM. Curium 242 und Curium 244 sind zwei der vielen radioaktiven Isotope von Curium -chemischem Element. Der Schlüsselunterschied zwischen Curium 242 und Curium 244 besteht darin, dass Curium 242 146 Neutronen in seinem Atomkern aufweist, während Curium 244 148 Neutronen in seinem Atomkern aufweist.
Referenz:
1. „Curium -Isotope.” Wikipedia, Wikimedia Foundation, 31. Dezember. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Elektronenschale 096 Curium" (CC BY-SA 2.0 uk) über Commons Wikimedia


