Unterschied zwischen Dehydration durch H2SO4 und H3PO4
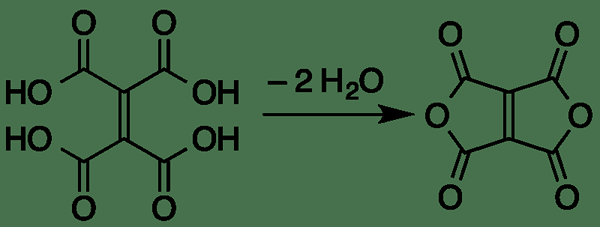
Der Schlüsselunterschied Zwischen Dehydration durch H2SO4 und H3PO4 ist das Dehydration durch H2SO4 ist weniger sicher und erleichtert eine komplexe Reaktion, während die Dehydration durch H3PO4 sicherer ist und eine weniger komplexe Reaktion erleichtert.
Dehydration ist im Grunde die Entfernung von H2O. Dehydration von Ethanol und anderen Alkoholen kann unter Verwendung von zwei verschiedenen Säurekatalysatoren durchgeführt werden: Schwefelsäure (H2SO4) und Phosphor (V) Säure (H3PO4). In diesem Prozess ist Ethanol dehydriert, um ein Alken -Produkt zu erhalten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Dehydration durch H2SO4
3. Was ist Dehydration von H3PO4
4. Seite für Seitenvergleich - Dehydration durch H2SO4 gegen H3PO4 in tabellarischer Form
5. Zusammenfassung
Was ist Dehydration durch H2SO4?
Die Dehydration durch H2SO4 ist ein chemischer Prozess, der bei der Bildung von Alkoholen von Alkoholen mit Schwefelsäure als Saurerkatalysator nützlich ist. Daher umfasst diese Reaktion die Bildung einer ungesättigten Verbindung von einer gesättigten Verbindung. Mit anderen Worten, die Reaktanten dieser Reaktion haben nur Einzelbindungen, während die Produkte dieser Reaktion sowohl Einzel- als auch Doppelbindungen haben.
Schwefelsäure ist ein saurer Katalysator für die Dehydration von Alkoholen. In diesem Prozess sollten wir konzentrierte Schwefelsäure verwenden. Die Verwendung dieses Säurekatalysators liefert jedoch etwas unordentliche Ergebnisse. Dies liegt daran. Daher treten diese beiden Gase als Verunreinigungen im Endprodukt auf und sollten entfernt werden. Darüber hinaus gibt es auch einige andere Reaktionen; Zum Beispiel reagiert Schwefelsäure mit Alkohol, um eine Kohlenstoffmasse zu ergeben.
Bei Dehydration wird der Alkohol in einem konzentrierten Zustand mit Schwefelsäure erhitzt. Hier sollte eine überschüssige Menge Schwefelsäure verwendet werden, um sicherzustellen, dass alle Alkohole mit der Säure reagieren. Eine Natriumhydroxidlösung kann verwendet werden, um die in dieser Reaktion erzeugten unerwünschten Gase zu entfernen.
Was ist Dehydration von H3PO4?
Dehydration durch H3PO4 ist ein chemischer Prozess, der bei der Bildung von Alkoholen von Alkoholen unter Verwendung von Phosphor (V) Säure als Säurekatalysator nützlich ist. Daher umfasst diese Reaktion die Bildung einer ungesättigten Verbindung von einer gesättigten Verbindung. Mit anderen Worten, die Reaktanten dieser Reaktion haben nur Einzelbindungen, während die Produkte dieser Reaktion sowohl Einzel- als auch Doppelbindungen haben.
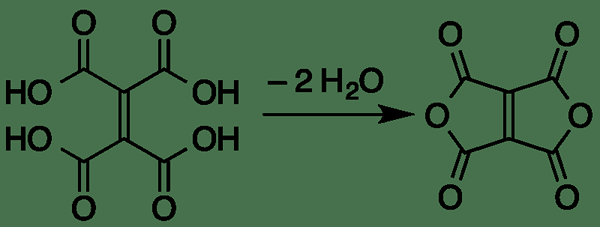
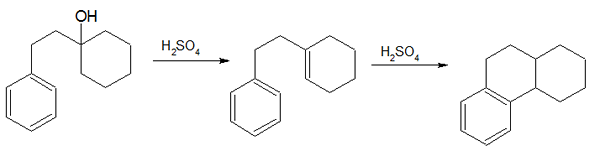
Abbildung 02: Dehydrationsreaktion
Ähnlich wie bei der oben diskutierten Methode benötigt diese Methode auch den sauren Katalysator in seinem konzentrierten Zustand. Wir müssen auch eine übermäßige Menge an Phosphor (V) -Säure verwenden, um sicherzustellen. Darüber hinaus wird die Dehydration unter Verwendung von Phosphorsäure hauptsächlich in der Produktion von Flüssigzustandsalkenen verwendet. Der Hauptvorteil dieser Reaktion gegenüber Dehydration durch Schwefelsäure besteht darin, dass diese Reaktion keine unordentlichen Ergebnisse liefert und vergleichsweise sicher ist (es werden keine schädlichen Produkte hergestellt, e.G. Schwefeldioxid, das bei der Verwendung von Schwefelsäure als Säurekatalysator hergestellt wird, ist ein schädliches Produkt).
Was ist der Unterschied zwischen Dehydration durch H2SO4 und H3PO4?
Die Dehydration durch H2SO4 ist ein chemischer Prozess, der bei der Bildung von Alkoholen von Alkoholen mit Schwefelsäure als Saurerkatalysator nützlich ist. Dehydration durch H3PO4 ist ein chemischer Prozess, der bei der Bildung von Alkoholen von Alkoholen unter Verwendung von Phosphor (V) Säure als Säurekatalysator nützlich ist. Der Schlüsselunterschied zwischen Dehydration durch H2SO4 und H3PO4 besteht darin, dass die Dehydration durch H2SO4 weniger sicher ist und eine komplexe Reaktion erleichtert.
Nachfolgend Infografik tabuliert mehr Vergleiche, um den Unterschied zwischen Dehydration durch H2SO4 und H3PO4 zu erkennen.

Zusammenfassung -Dehydration durch H2SO4 gegen H3PO4
Die Dehydration von Ethanol und anderen Alkoholen kann unter Verwendung von zwei verschiedenen Säurekatalysatoren durchgeführt werden. Schwefelsäure und Phosphor (V) Säure. Der Schlüsselunterschied zwischen Dehydration durch H2SO4 und H3PO4 besteht darin, dass die Dehydration durch H2SO4 weniger sicher ist und eine komplexe Reaktion erleichtert.
Bild mit freundlicher Genehmigung:
1. "Bogert -Cook -Synthese" von Mephisto Spa - eigene Arbeit (Public Domain) über Commons Wikimedia
2. „Ethylenetetracarboxylic Dianhydrid über Säuredehydration“ von DMACKS (DECK) - eigene Arbeit (Public Domain) über Commons Wikimedia


