Unterschied zwischen Deuterium und Tritium
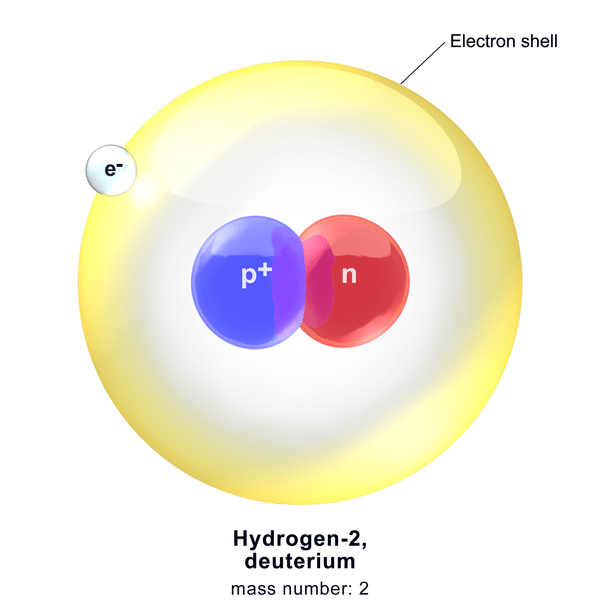
Der Schlüsselunterschied Zwischen Deuterium und Tritium ist das Der Deuterium -Kern hat ein Neutron, während der Tritiumkern zwei Neutronen hat.
Wasserstoff ist das erste und kleinste Element in der Periodenzüchttabelle, die wir als h bezeichnen. Es hat ein Elektron und ein Proton. Wir können es aufgrund seiner Elektronenkonfiguration unter Gruppe 1 und Periode 1 in der Periodenzüchttabelle einkategien: 1S1. Wasserstoff kann ein Elektron aufnehmen, um ein negativ geladenes Ion zu bilden, oder das Elektron leicht spenden kann, um ein positiv geladenes Proton zu erzeugen. Wenn nicht, kann es das Elektron teilen, um kovalente Bindungen herzustellen. Aufgrund dieser Fähigkeit ist Wasserstoff in einer großen Anzahl von Molekülen vorhanden und ist ein sehr häufiges Element in der Erde. Wasserstoff hat drei Isotope als Protium-1H (keine Neutronen), Deuterium-2H (ein Neutron) und Tritium-3h (zwei Neutronen). Protium ist unter diesen drei am häufigsten mit etwa 99% relativer Häufigkeit.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Deuterium
3. Was ist Tritium
4. Nebenseitiger Vergleich - Deuterium gegen Tritium in tabellarischer Form
5. Zusammenfassung
Was ist Deuterium?
Deuterium ist einer der Isotope von Wasserstoff. Es ist ein stabiles Isotop mit 0.015% natürliche Häufigkeit. Es gibt ein Proton und ein Neutron im Kern von Deuterium. Daher beträgt seine Massenzahl zwei und die Atomzahl ist eine. Wir nennen dieses Isotop als schwerer Wasserstoff und wird als 2H dargestellt. Am häufigsten repräsentieren wir es jedoch mit D.

Abbildung 1: Deuterium
Deuterium kann als diatomisches Gasmolekül mit der chemischen Formel D2 existieren. Die Möglichkeit, zwei D -Atome in der Natur zu beitreten. Daher bindet dieses Isotop hauptsächlich mit einem 1 -stündigen Atom, das ein Gas -HD (Wasserstoff Deuterid) macht. Außerdem können zwei Deuterium -Atome mit Sauerstoff binden, um das Wasseranalog -D2O zu bilden, das wir schweres Wasser nennen.
Darüber hinaus zeigen Moleküle mit Deuterium unterschiedliche chemische und physikalische Eigenschaften als das Wasserstoffanalogon von ihnen. Zum Beispiel kann es einen kinetischen Isotopeffekt aufweisen. Darüber hinaus zeigen deuterierte Verbindungen charakteristische Unterschiede in der NMR-, IR- und Massenspektroskopie; Daher können wir es anhand dieser Methoden identifizieren. Auch Deuterium hat einen Dreh von einem. Daher gibt die Kopplung dieses Isotops in NMR ein Triplett. Darüber hinaus absorbiert es eine andere IR -Frequenz als Wasserstoff in der IR -Spektroskopie. Aufgrund des großen Massenunterschieds kann Deuterium in der Massenspektroskopie von Wasserstoff unterschieden werden.
Was ist Tritium?
Tritium ist das Isotop von Wasserstoff, dessen Massenzahl drei beträgt. Daher hat der Kern von Tritium ein Proton und zwei Neutronen. Es existiert nur in der Natur in der Natur aufgrund seiner Radioaktivität. Aus diesem Grund muss es künstlich für den praktischen Gebrauch produziert werden.
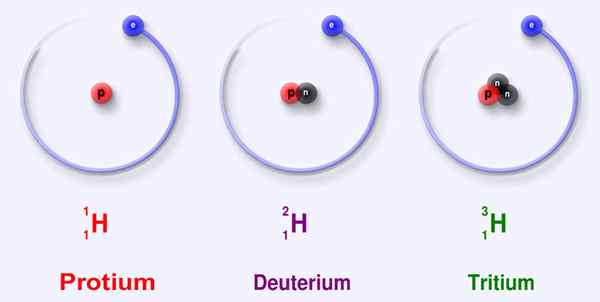
Abbildung 02: Drei Hauptisotope Wasserstoff
Tritium ist ein radioaktives Isotop (dies ist das einzige radioaktive Isotop von Wasserstoff). Es hat eine Halbwertszeit von 12 Jahren und verfälscht, indem es ein Beta-Partikel ausgibt, um Helium-3 zu produzieren. Die Atommasse dieses Isotops beträgt 3.0160492. Außerdem existiert es als Gas (HT) bei Standardtemperatur und Druck. Außerdem kann es das Oxid (HTO) bilden, das wir „tritiiertes Wasser nennen.„Tritium ist nützlich bei der Herstellung von Atomwaffen und als Tracer in biologischen und Umweltstudien.
Was ist der Unterschied zwischen Deuterium und Tritium?
Deuterium und Tritium sind zwei Isotope Wasserstoff. Der Schlüsselunterschied zwischen Deuterium und Tritium besteht darin, dass der Deuterium -Kern ein Neutron aufweist, während der Tritiumkern zwei Neutronen hat. Darüber hinaus beträgt die Massenzahl von Deuterium 2.0135532, während die Massenzahl von Tritium 3 beträgt.0160492. Dies ist also ein weiterer signifikanter Unterschied zwischen Deuterium und Tritium.
Darüber hinaus besteht ein weiterer Unterschied zwischen Deuterium und Tritium darin, dass das Deuterium ein stabiles Isotop ist und wir es in der Natur finden können, während Tritium ein radioaktives Isotop ist, das wir in der Natur nicht finden können. Wir können es jedoch künstlich für den praktischen Gebrauch produzieren.

Zusammenfassung -Deuterium gegen Tritium
Deuterium und Tritium sind Isotope des Wasserstoffs des chemischen Elements. Der Schlüsselunterschied zwischen Deuterium und Tritium besteht darin. Darüber hinaus ist Tritium radioaktiv, während Deuterium ein stabiles Isotop ist.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Deuterium Fakten.”Thoughtco, APR. 2, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Blausen 0527 Wasserstoff -2 Deuterium" von Bruceblaus - eigene Arbeit (CC von 3.0) über Commons Wikimedia
2. "Protium Deuterium Tritium" von Lamiot for French Version, von Dirk Hünniger - Selbst, Übersetzung von Dirk Hünniger (Deutsche Wikipedia) (CC BY -SA 3.0) über Commons Wikimedia


