Unterschied zwischen Unverhältnisungen und Redox

Der Schlüsselunterschied Zwischen Unverhältnisungen und Redox ist das Bei Reaktionen bei unverhältnismäßigen Verhältnissen erfährt der gleiche Reaktant eine Oxidation und Reduktion. Bei Redoxreaktionen werden jedoch zwei verschiedene Reaktanten normalerweise oxidiert und reduziert.
Darüber hinaus ist die Unproportionierung eine chemische Reaktion, bei der ein Molekül in zwei oder mehr unähnliche Produkte umgewandelt wird, während Redoxreaktion eine Art chemische Reaktion ist, bei der gleichzeitig Oxidation und Reduktionsshälfte auftreten. Vor allem ist eine Diplomproportionierung eine Art Redoxreaktion, da es zwei gleichzeitige Oxidations- und Reduktionsreaktionen gibt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist unverhältnismäßig
3. Was ist Redox
4. Nebenseitiger Vergleich - Diolproportionierung gegen Redox in tabellarischer Form
5. Zusammenfassung
Was ist unverhältnismäßig?
Die Unverhältnis ist eine chemische Reaktion, bei der ein Molekül in zwei oder mehr unterschiedliche Produkte umgewandelt wird. Grundsätzlich handelt es sich um eine Art von Redoxreaktion, bei der das gleiche Molekül sowohl Oxidation als auch Reduktion erfährt. Darüber hinaus wird die Rückseite dieser Reaktion genannt Komproportion. Die allgemeine Form dieser Reaktionen ist wie folgt:
2a ⟶ a ' +a ”
Darüber hinaus sind einige häufige Beispiele für diese Art von Reaktionen wie folgt
- Umwandlung von Wasserstoffperoxid in Wasser und Sauerstoff
2H2Ö2 ⟶ h2O +o2
- Überproportionierung von Quecksilber (i) Chlorid
Hg2Cl2 → Hg + Hgcl2
- Überproportionierung von Phosphorsäure in Phosphorsäure und Phosphin
4 h3Po3 → 3 h3Po4 + PH3
- Die Unverhältnis von Bromfluorid verleiht Brom Trifluorid und Brom
3 BRF → BRF3 + Br2
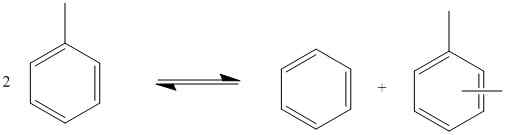
Abbildung 01: Unverhältnis von Toluol
Was ist Redox?
Redox-Reaktion ist eine Art chemischer Reaktion, bei der gleichzeitig Oxidation und Reduktion halbe Reaktionen auftreten. Darüber hinaus betrachten wir in dieser Reaktion Oxidation und Reduktion als komplementäre Prozesse. Hier ist Oxidation der Elektronenverlust oder die Zunahme des Oxidationszustands, während die Verringerung der Elektronengewinn oder der Abnahme des Oxidationszustands ist.

Abbildung 02: Rosting
Darüber hinaus kann die Geschwindigkeit einer Redoxreaktion von sehr langsamen Prozessen wie Rost bis hin zu schnellen Prozessen wie Kraftstoffverbrennung variieren.
Was ist der Unterschied zwischen Unverhältnisungen und Redox?
Der Hauptunterschied zwischen Unverhältnisungen und Redox besteht darin, dass bei Disportierungsreaktionen derselbe Reaktant oxidieren und reduziert werden, während bei Redoxreaktionen zwei verschiedene Reaktanten normalerweise oxidiert und reduziert werden. In Anbetracht einiger Beispiele beinhaltet die Unverhältnisung von Merkur (I) Chlorid zur Bildung von Quecksilber und Quecksilber (ii) Chlorid, Unverhältnis von Bromfluorid zur Bildung von Brom -Trifluorid und Brom usw. während Rosting, Verbrennung, Kraftstoffverbrennung usw. sind Beispiele für Redoxreaktionen.
Die folgende Infografik fasst den Unterschied zwischen Unverhältnisungen und Redox zusammen.

Zusammenfassung -Unproportionierung gegen Redox
Die Unverhältnis ist eine chemische Reaktion, bei der ein Molekül in zwei oder mehr unterschiedliche Produkte umgewandelt wird, während Redox-Reaktion eine Art chemische Reaktion ist, bei der gleichzeitig Oxidation und Reduktionsshälfte auftreten. Der Hauptunterschied zwischen Unverhältnisungen und Redox besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Definition der unverhältnismäßigen Verhältnis in der Chemie.”Thoughtco, August. 6, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Unverhältnis von Toluene" von Warrenjlange - eigener Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Rostschraube" von Benutzer: Paulnasca - eigene Arbeit (CC von 2.0) über Commons Wikimedia


