Unterschied zwischen Dissoziation und Solvatation
Der Schlüsselunterschied Zwischen Dissoziation und Solvation ist das Dissoziation ist der Aufbau einer Substanz in die Atome oder Ionen, aus denen die Substanz besteht.
Dissoziation und Solvatation werden häufig in der analytischen Chemie und in der anorganischen Chemie in Bezug auf den Abbau chemischer Substanzen auf unterschiedliche Wechselwirkungen zwischen Atomen und Ionen in einer Substanz gefunden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Dissoziation
3. Was ist Solvation
4. Seite für Seitenvergleich - Dissoziation gegen Solvation in tabellarischer Form
5. Zusammenfassung
Was ist Dissoziation?
Der Begriff Dissoziation bezieht sich auf den Abbau oder die Spaltung einer Verbindung in kleinere Partikel. Der Dissoziationsprozess bildet Produkte, die entweder elektrisch aufgeladen oder neutral sind. Das bedeutet; Die Produkte der Dissoziation können entweder ionisch oder nichtionisch sein. Dies beinhaltet jedoch nicht den Gewinn oder den Verlust von Elektronen durch die Atome.
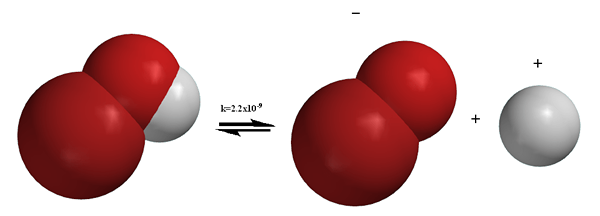
Abbildung 01: Dissoziation des Broh -Moleküls
Im Gegensatz zum Ionisationsprozess beinhaltet die Dissoziation die Trennung von Ionen, die bereits in einer Verbindung existierten. Manchmal kann die Dissoziation auch neutrale Partikel erzeugen, zum Beispiel den Abbau von N2Ö4 führt zur Produktion von zwei Molekülen von NO2. Dissoziationsprozesse sind die meiste Zeit reversibel. Das heißt, getrennte Ionen können neu arrangiert werden, um die vorherige Verbindung zu produzieren. Wie oben erwähnt, ist das Auflösen von NaCl beispielsweise ein Dissoziationsprozess und erzeugt zwei geladene Partikel. Solid NaCl kann jedoch erneut mit gegebenen ordnungsgemäßen Bedingungen erhalten werden, was beweist, dass die Dissoziation reversibel ist. Im Gegensatz zur Ionisation findet die Dissoziation in ionischen Verbindungen statt.
Was ist Solvation?
Solvation ist die Auflösung einer Substanz in einem bestimmten Lösungsmittel. Die Solvatation tritt aufgrund der Anziehungskraft zwischen Molekülen des Lösungsmittels und den gelösten Molekülen auf. Normalerweise sind die Anziehungskräfte, die an diesem Prozess beteiligt sind. Diese Anziehungskräfte verursachen die Auflösung eines gelösten Stoffes in einem Lösungsmittel.

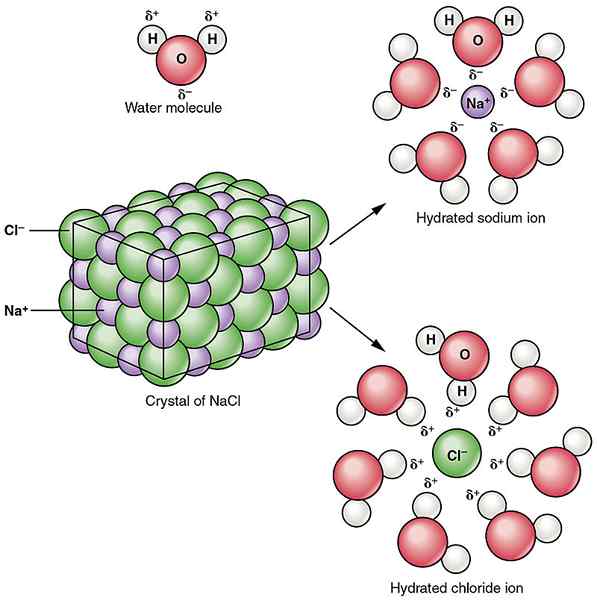
Abbildung 02: Solvatation von Natriumchlorid -ionischer Verbindung in Wasser
Die Ionen-Dipol-Wechselwirkungen können zwischen ionischen Verbindungen und polaren Lösungsmitteln gefunden werden. E.G. Wasser ist ein polares Lösungsmittel. Wenn Natriumchlorid zu Wasser zugesetzt wird, ziehen die polaren Wassermoleküle die Natriumionen und Chloridionen getrennt an, wodurch das Natrium- und Chloridionen zerbricht. Dies führt zum Abbau der Natriumchlorid -ionischen Verbindung.
Was ist der Unterschied zwischen Dissoziation und Solvatation?
Dissoziation und Solvatation sind Begriffe, die beschreiben, wie unterschiedliche Substanzen je nach Wechselwirkungen in kleine Stücke oder Atome/Ion einbrechen. Der Hauptunterschied zwischen Dissoziation und Solvatation besteht darin, dass die Dissoziation der Aufbau einer Substanz in die Atome oder Ionen, aus denen die Substanz besteht der Substanz.
Die folgende Tabelle zeigt mehr Unterschiede zwischen Dissoziation und Solvatation.
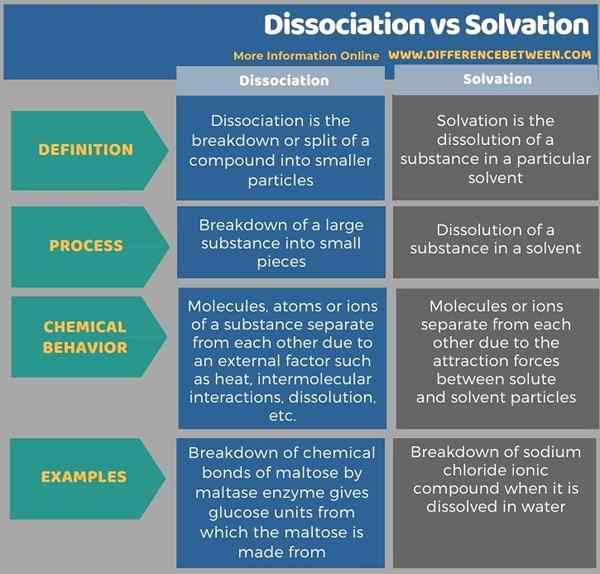
Zusammenfassung -Dissoziation gegen Solvatation
Der Hauptunterschied zwischen Dissoziation und Solvatation besteht darin, dass die Dissoziation der Aufbau einer Substanz in die Atome oder Ionen, aus denen die Substanz besteht der Substanz.
Referenz:
1. „Lösungen, Solvatation und Dissoziation.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
2. „Solvation und Dissoziation.Sokratisch.org, hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Broh -Säure -Dissoziation" von Achow801 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "214 Dissoziation von Natriumchlorid in Water -01" vom OpenStax College - Anatomy & Physiology, Connexions -Website, 19. Juni 2013 (CC von 3.0) über Commons Wikimedia


