Unterschied zwischen Ebullioskopiekonstante und kryoskopische Konstante
Der Schlüsselunterschied zwischen der ebullioskopischen Konstante und der kryoskopischen Konstante ist das Die eBullioskopische Konstante hängt mit der Erhöhung einer Substanz in Bezug.
Ebullioskopische Konstante und kryoskopische Konstante sind Begriffe, die hauptsächlich in der Thermodynamik verwendet werden, um die Eigenschaften einer Substanz in Bezug auf die Temperaturänderungen zu beschreiben. Diese beiden Konstanten geben für eine bestimmte Substanz unter ähnlichen Bedingungen über verschiedene Routen den gleichen Wert an.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eBullioskopische Konstante
3. Was ist kryoskopische Konstante
4. Seite für Seitenvergleich - Ebullioskopische Konstante und kryoskopische Konstante in tabellarischer Form
5. Zusammenfassung
Was ist eBullioskopische Konstante?
Eine eBullioskopische Konstante ist ein thermodynamischer Term, der die Molalität einer Substanz zu seiner Erhöhungspunkterhöhung bezieht. Wir können die eBullioskopische Konstante als KB -Erhöhung als ΔT und Molalität als „B“ bezeichnen, als „B“. Die Konstante wird als Verhältnis zwischen der Erhöhung der Siede und der Molalität angegeben (Siedepunkterhöhung geteilt durch Molalität gleich Ebullioskopischer Konstante, kb). Wir können den mathematischen Ausdruck für diese Konstante wie folgt geben:
Δt = ikBB
In dieser Gleichung ist „ich“ der Van't Hoff -Faktor. Es gibt die Anzahl der Partikel an, die der gelöste gelöste in in ein Lösungsmittel gelöst wird oder bildet, wenn die Substanz gelöst wird. "B" ist die Molalität der nach dieser Auflösung gebildeten Lösung. Zusätzlich zu dieser einfachen Gleichung können wir einen anderen mathematischen Ausdruck verwenden, um die ebullioskopische Konstante theoretisch zu berechnen:
KB = Rt2BM/ ΔHVAP
In dieser Gleichung bezieht sich R auf die ideale (oder universelle) Gaskonstante, TB auf den Siedepunkt des Lösungsmittels, M bezieht sich auf die Molmasse des Lösungsmittels und ΔHVAP bezieht sich auf die molare Enthalpie der Verdampfung. Bei der Berechnung der Molmasse einer Substanz können wir jedoch einen bekannten Wert für diese Konstante unter Verwendung eines Verfahrens namens Ebullioskopie verwenden. Ebullioscopy bezieht sich auf die „kochende Messung“ in lateinischer Bedeutung.

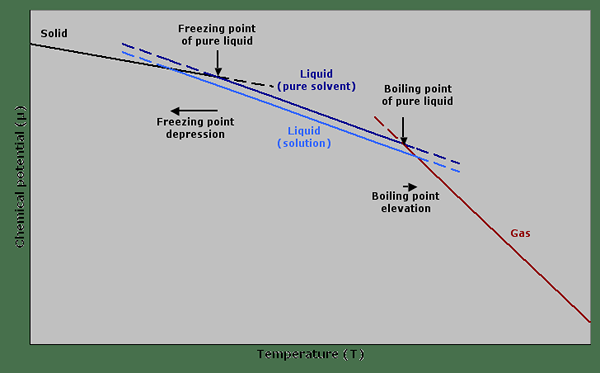
Abbildung 01: Gefrierpunkt -Depression und Siedepunkterhöhung in einem Diagramm
Die Eigenschaft des Erhöhung des Siedepunkts wird als eine kolligative Eigenschaft angesehen, in der die Eigenschaft von der Anzahl der in das Lösungsmittel gelösten Partikel abhängt und nicht von der Art dieser Partikel. Einige bekannte Werte für die Ebullioskopische Konstante umfassen Essigsäure mit 3.08, Benzol mit 2.53, Kampfer mit 5.95 und Kohlenstoffdisulfid mit 2.34.
Was ist kryoskopische Konstante?
Eine kryoskopische Konstante ist ein thermodynamischer Term, der die Molalität einer Substanz zur Gefrierpunktdepression bezieht. Die Gefrierpunktdepression ist auch eine kolligative Eigenschaft von Substanzen. Die kryoskopische Konstante kann wie unten angegeben werden:
ΔtF = ikFB
Hier ist „I“ der Van't Hoff -Faktor, der die Anzahl der Partikel ist, die der gelöste gelöste in ein Lösungsmittel aufgeteilt oder sich bilden kann. Kryoskopie ist der Prozess, mit dem wir die kryoskopische Konstante einer Substanz bestimmen können. Wir können eine bekannte Konstante verwenden, um eine unbekannte Molmasse zu berechnen. Der Begriff Kryoskopie stammt aus der griechischen Bedeutung „Einfriermessung“.
Da die Gefrierpunkt -Depression eine kolligative Eigenschaft ist, hängt sie nur von der Anzahl der gelösten gelösten gelösten Partikel ab und nicht von der Art dieser Partikel. Daher können wir sagen, dass die Kryoskopie mit Ebullioskopie zusammenhängt. Der mathematische Ausdruck für diese Konstante lautet wie folgt:
KB = Rt2FM/ ΔHFus
Wo R die ideale Gaskonstante ist, ist M die Molmasse des Lösungsmittels, tF ist der Gefrierpunkt des reinen Lösungsmittels und ΔHFus ist die molare Enthalpie der Fusion des Lösungsmittels.
Was ist der Unterschied zwischen der ebullioskopischen Konstante und der kryoskopischen Konstante?
Ebullioskopische Konstante und kryoskopische Konstante sind Begriffe, die in der Thermodynamik verwendet werden. Der Schlüsselunterschied zwischen der ebullioskopischen Konstante und der kryoskopischen Konstante besteht darin.
Die folgende Infografik fasst die Unterschiede zwischen eBullioskopischer Konstante und kryoskopischer Konstante zusammen.

Zusammenfassung -Ebullioskopische Konstante gegen kryoskopische Konstante
Der Schlüsselunterschied zwischen der Ebullioskopischen Konstante und der kryoskopischen Konstante besteht darin.
Referenz:
1. „Kryoskopische Konstante.”Wikipedia, Wikimedia Foundation, 4. Februar. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Gefrierpunkt-Depression und Siedepunkterhöhung"- Modifiziert Freezing_Point_Depression_and_boiling_point_elevation.PNG von Tomas ER (CC BY-SA 3.0) über Commons Wikimedia


