Unterschied zwischen Elektrodenpotential und Zellpotential
Der Schlüsselunterschied Zwischen dem Elektrodenpotential und dem Zellpotential ist das Das Elektrodenpotential bezieht sich auf die Fähigkeit einer Elektrode in einer Zelle, reduziert oder oxidiert zu werden, während das Zellpotential die Differenz zwischen den Elektrodenpotentialen der in einer elektrochemischen Zelle vorhandenen Elektroden ist.
Elektrodenpotential und Zellpotential sind Begriffe, die die elektromotive Kraft einer elektrochemischen Zelle erklären. Das Elektrodenpotential ergibt das Voltaikpotential einer einzelnen Elektrode, während das Zellpotential die Elektrodenpotentiale beider Elektroden berücksichtigt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Elektrodenpotential
3. Was ist Zellpotential
4. Seite für Seitenvergleich - Elektrodenpotential gegen Zellpotential in tabellarischer Form
5. Zusammenfassung
Was ist Elektrodenpotential?
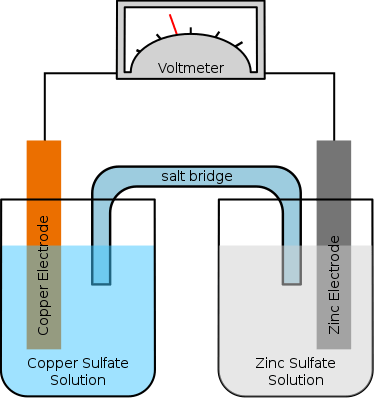
Das Elektrodenpotential ist die Tendenz einer Elektrode in einer elektrochemischen Zelle, reduziert oder oxidiert zu werden. Es ist die elektromotive Kraft einer Zelle. Es gibt drei Faktoren, die den Wert des Elektrodenpotentials beeinflussen: Art der Elektrode, die Konzentration der Ionen in der Elektrolytlösung und Temperatur. Für jede elektrochemische Zelle ist das Gesamtpotential die Summe der Elektrodenpotentiale der beiden Elektroden. Wir können das Elektrodenpotential als e bezeichnen. Wir können das Elektrodenpotential jedoch nicht isoliert messen. Es muss in einer Reaktion mit einer anderen Elektrode gemessen werden.

Abbildung 01: Eine einfache elektrochemische Zelle
Darüber hinaus hängt das Elektrodenpotential von den Konzentrationen der Elektroden, der Temperatur der elektrochemischen Zelle und dem Druck ab (wenn die Zelle Gaselektroden enthält). Im Allgemeinen werden die Elektrodenpotentiale in Bezug auf eine Standardelektrode gemessen.
Die typische Standardelektrode ist die Wasserstoffelektrode und ihr Elektrodenpotential wird als Null angenommen. Darüber hinaus müssen wir bei der Messung der Potentiale Standard -thermodynamische Bedingungen verwenden. Andernfalls können wir nicht den genauen potenziellen Wert erhalten, da das Elektrodenpotential von der Temperatur, dem Druck usw. abhängt. Hier umfassen die thermodynamischen Standardbedingungen die Messung gegen eine Wasserstoffelektrode, eine elektrolytische Lösung mit einer Konzentration von 1 mol/l, Druck von 1 atm und eine Temperatur von 25 ° C.
Was ist Zellpotential?
Das Zellpotential bezieht sich auf das Gesamtvoltaikpotential einer elektrochemischen Zelle mit zwei Elektroden. Hier sollten die elektrochemischen Zellen zwei separate Halbreaktionen haben, die parallel zueinander stattfinden, und dann ist das Zellpotential wie folgt:
EZelle = Oxidationspotential+ Reduktionspotential
Daher ist das Zellpotential die Summe des Kathodenelektrodenpotentials und des Anode -Elektrodenpotentials. Eine echte Volta -Zelle unterscheidet sich von Standardbedingungen. Daher müssen wir den experimentellen Wert anpassen, um den Standardwert zu erhalten. Es ist wie folgt:
EZelle = E0Zelle - (RT/NF) LNQ
Wo eZelle ist das experimentelle Zellpotential e0Zelle ist das Standardzellenpotential, R ist die universelle Konstante, t ist die Temperatur, n ist die Mol der Elektronen, die in halben Reaktionen ausgetauscht werden, f ist die Faraday-Konstante und Q ist das thermodynamische Reaktionsquotient.
Was ist der Unterschied zwischen Elektrodenpotential und Zellpotential?
Der Schlüsselunterschied zwischen dem Elektrodenpotential und dem Zellpotential besteht darin, dass sich das Elektrodenpotential auf die Fähigkeit einer Elektrode in einer Zelle bezieht, reduziert oder oxidiert zu werden, während das Zellpotential der Unterschied zwischen den Elektrodenpotentialen der in einer elektrochemischen Zell vorhandenen Elektroden ist. Daher ergibt das Elektrodenpotential das Voltaikpotential einer einzelnen Elektrode, während das Zellpotential beide Elektroden berücksichtigt.
Ein weiterer signifikanter Unterschied zwischen Elektrodenpotential und Zellpotential besteht darin, dass es unmöglich ist, das Elektrodenpotential zu messen, da es sich um einen relativen Wert handelt. Das Zellpotential kann jedoch leicht gemessen werden.
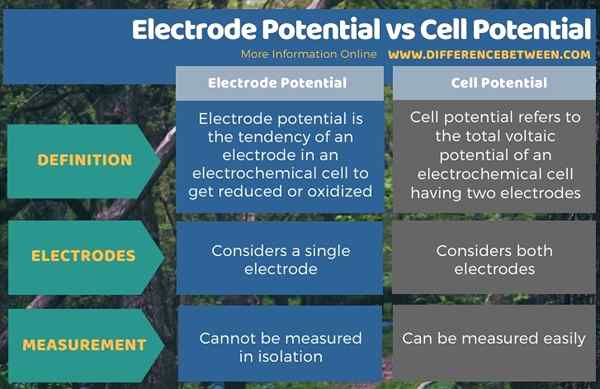
Zusammenfassung -Elektrodenpotential gegen Zellpotential
Elektrodenpotential und Zellpotential werden unter Elektrochemie in Bezug auf elektrochemische Zellen diskutiert. Der Schlüsselunterschied zwischen dem Elektrodenpotential und dem Zellpotential besteht darin, dass sich das Elektrodenpotential auf die Fähigkeit einer Elektrode in einer Zelle bezieht, reduziert oder oxidiert zu werden, während das Zellpotential der Unterschied zwischen den Elektrodenpotentialen der in einer elektrochemischen Zell vorhandenen Elektroden ist.
Referenz:
1. „Standard -Elektrodenpotentiale.” Hyperphysik, Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Galvanische Zelle" von Gringer - Datei: Galvanische Zelle.PNG nach Tinux (CC BY-SA 3.0) über Commons Wikimedia


