Unterschied zwischen elektrolytischer Reduktion und Verfeinerung
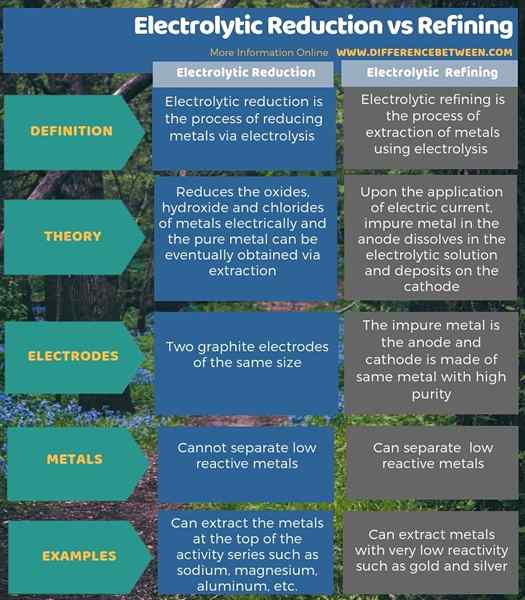
Der Schlüsselunterschied Zwischen elektrolytischer Reduktion und Verfeinerung ist das Die elektrolytische Reduktionsmethode verwendet Graphitelektroden derselben Größe, während die elektrolytische Raffinierungsmethode unreine Metall als Anode und eine Kathode aus demselben Metall mit hoher Reinheit verwendet.
Elektrolytische Reduktion und Raffination sind zwei wichtige Industriemethoden, mit denen wir ein Metall reinigen können. Bei der Elektrolytreduktion können wir Metalle in niedrige Oxidationszustände reduzieren, was eine einfache Extraktion ermöglicht. Bei der elektrolytischen Verfeinerungsmethode wird das Metall von unreiner Anode auf der Kathode abgelehnt, sodass wir das Metall aus der Kathode extrahieren können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist elektrolytische Reduktion
3. Was ist elektrolytische Verfeinerung
4. Seite für Seitenvergleich - Elektrolytische Reduktion gegenüber Verfeinerung in tabellarischer Form
5. Zusammenfassung
Was ist elektrolytische Reduktion?
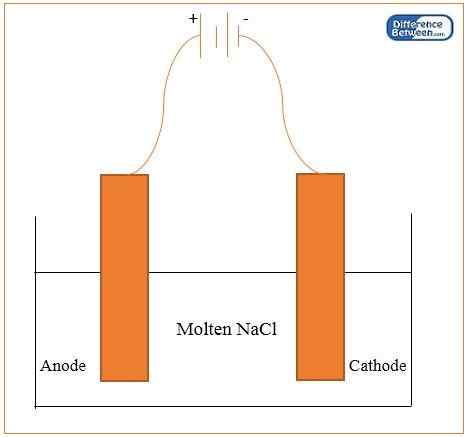
Die elektrolytische Reduktion ist der Prozess der Reduzierung von Metallen durch Elektrolyse. In diesem Prozess verwenden wir zwei Graphitelektroden derselben Größe wie Anode und Kathode. Der Prozess beinhaltet die Reduktion von Oxiden, Hydroxiden und Chloriden von Metallen (die sich in einem fusionierten Zustand befinden). Hier können wir diese Metalle in der Kathode extrahieren. Die Beispiele für Metalle, die wir über dieses Verfahren erhalten können, umfassen Natrium, Magnesium, Calcium und Aluminium. Bei dieser Methode können wir Metalle mit hoher Reinheit erhalten. Wir können jedoch nicht mit dieser Technik Metalle mit geringer Reaktivität extrahieren. Es liegt daran, dass sie weniger stabile Oxide bilden.

Abbildung 01: Gerät für die elektrolytische Reduktion von Natrium
Normalerweise funktionieren die meisten Extraktionstechniken nicht auf Metallen, die ganz oben auf der Aktivitätsserie stehen. Die beste Methode für ihre Extraktion ist die elektrolytische Reduktion, da sie stark elektropositiv sind und wir Kohlenstoff als Reduktionsmittel nicht verwenden können, um sie zu reduzieren.
Was ist elektrolytische Verfeinerung?
Elektrolytische Raffinierung ist der Prozess der Extraktion von Metallen (Metalle, die wir von jedem Raffinerierverfahren erhalten können) unter Verwendung der Elektrolyse. Bei dieser Methode ist die Anode ein unreiner Metallblock, aus dem wir das Metall extrahieren werden, während die Kathode ein Block desselben Metalls mit hoher Reinheit ist. Außerdem ist die elektrolytische Lösung eine wässrige Lösung des Salzes dieses bestimmten Metalls (das Metall, das wir extrahieren werden). Dann können wir einen elektrischen Strom durch diese elektrolytische Zelle durchlaufen. Es wird die Auflösung des Metalls aus der Anode verursachen und schließlich auf der Kathode ablegt. Daher können wir das reine Metall von der Kathode sammeln. Beispiele hier.
Was ist der Unterschied zwischen elektrolytischer Reduktion und Verfeinerung?
Die elektrolytische Reduktion ist der Prozess der Reduzierung von Metallen durch Elektrolyse, während die elektrolytische Raffinierung das Extraktionsprozess von Metallen unter Verwendung von Elektrolyse ist. Der Schlüsselunterschied zwischen elektrolytischer Reduktion und Raffination besteht darin.
Darüber hinaus reduziert die elektrolytische Reduktion die Oxide, das Hydroxid und die Chloride von Metallen elektrisch, und wir können irgendwann durch Extraktion reines Metall erhalten. Bei der elektrolytischen Verfeinerung löst sich bei Anwendung von elektrischem Strom in der Anode jedoch unreine Metall.
Die folgende Infografik zeigt weitere Informationen zum Unterschied zwischen Elektrolytreduzierung und Raffination.
Zusammenfassung -elektrolytische Reduktion gegenüber Verfeinerung
Die elektrolytische Reduktion ist der Prozess der Reduzierung von Metallen durch Elektrolyse, während die elektrolytische Raffinierung das Extraktionsprozess von Metallen unter Verwendung von Elektrolyse ist. Der wichtigste Unterschied zwischen elektrolytischer Reduktion und Verfeinerung besteht darin.
Referenz:
1. Azomining, geschrieben von. „Elektrolytische Raffinern - Bergbaufundamentaldaten.”Com, 25. April. 2014, hier erhältlich.
2.„Metalle & Nicht -Metalle.”Elektrolytische Reduktionschemie, hier verfügbar.


