Unterschied zwischen elektrophoretischer und asymmetrischer Wirkung
Der Schlüsselunterschied zwischen elektrophoretischer und asymmetrischer Wirkung ist das Elektrophoretische Wirkung ist die Wirkung der Anziehungskräfte zwischen ionischen Spezies und Lösungsmittelmolekülen auf die Bewegung von Ionen, während die asymmetrische Wirkung die Wirkung der hohen Ionenkonzentration in der Lösung auf die Bewegung von Ionen ist.
Der elektrophoretische Effekt und der asymmetrische Effekt werden normalerweise unter dem Thema „Elektrolytische Leitfähigkeit“ diskutiert. Elektrolytische Leitfähigkeit beschreibt die Bewegung ionischer Spezies (Kationen und Anionen) in einer Lösung. Es gibt zwei Haupttypen von Effekten, die Änderungen an der ionischen Leitfähigkeit vornehmen können: elektrophoretische Wirkung und asymmetrischer Effekt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist elektrophoretische Wirkung
3. Was ist ein asymmetrischer Effekt
4. Seite an Seite Vergleich - elektrophoretischer gegen asymmetrischer Effekt in tabellarischer Form
5. Zusammenfassung
Was ist elektrophoretische Wirkung?
Die elektrophoretische Wirkung ist die Wirkung von Lösungsmittelmolekülen auf die Bewegung eines bestimmten Ions in einer Lösung. Es ist ein wichtiger Faktor, der die Bewegung von Ionen innerhalb einer Lösung verlangsamen kann. Aufgrund der attraktiven Kräfte zwischen den Lösungsmittelmolekülen und den ionischen Spezies in der Lösung neigt es dazu, die ionische Atmosphäre um ein bestimmtes sich bewegendes Ion selbst zu bewegen. Dieses sich bewegende Ion befindet sich im Zentrum der ionischen Atmosphäre. Aufgrund dieser elektrophoretischen Wirkung wird das zentrale Ion beeinflusst, um sich in Richtung des Pols seiner ionischen Atmosphäre zu bewegen, was die langsame Bewegung des Ions verursacht.

Abbildung 01: Eine Lösung mit einem externen elektrischen Potential, das darauf verwendet wird
Was ist ein asymmetrischer Effekt?
Asymmetrischer Effekt ist die Wirkung anderer Ionen auf die Bewegung eines bestimmten Ions in einer Lösung. Mit anderen Worten, dies bedeutet eine Lösung, die eine hohe ionische Konzentration enthält. Wenn wir ein elektrisches Potential auf eine elektrolytische Lösung anwenden, bewegen sich die positiven Ionen oder die Kationen in der Lösung in Richtung der negativen Elektrode und die negativen Ionen oder die Anionen in Richtung der positiven Elektrode. Wenn die Konzentration der Lösung hoch ist, kommen die negativen Ionen den positiven Ionen näher. Dann gibt es einen Widerstand gegen die ionische Spezies, die die Geschwindigkeit des sich bewegenden Ions beeinflusst. Wir nennen diesen Effekt den asymmetrischen Effekt. Der Name „asymmetrisch“ wird angegeben, da die Ionenkugel um das sich bewegende Ion aufgrund der hohen ionischen Konzentration nicht symmetrisch ist.
In einer hoch konzentrierten ionischen Lösung sind die Anziehungskräfte zwischen den positiven und negativen Ionen großartig. Wenn ein elektrisches Potential auf ein bestimmtes Ion angewendet wird, ist die Ladungsdichte der entgegengesetzten Ladungen im Rücken höher als die vorne. Daher verlangsamt es die Bewegung des Ions. Dies geschieht aufgrund der asymmetrischen Ladungsdichte in der elektrolytischen Lösung.
Was ist der Unterschied zwischen elektrophoretischer und asymmetrischer Wirkung?
Die elektrolytische Leitfähigkeit definiert die Bewegung ionischer Spezies (Kationen und Anionen) in einer Lösung. Es gibt zwei Haupttypen von Effekten, die Änderungen an der ionischen Leitfähigkeit vornehmen können: elektrophoretische Wirkung und asymmetrische Wirkung. Der Schlüsselunterschied zwischen elektrophoretischer und asymmetrischer Wirkung besteht darin.
Nachfolgend finden Sie eine zusammenfassende Tabelle des Unterschieds zwischen elektrophoretischer und asymmetrischer Wirkung.
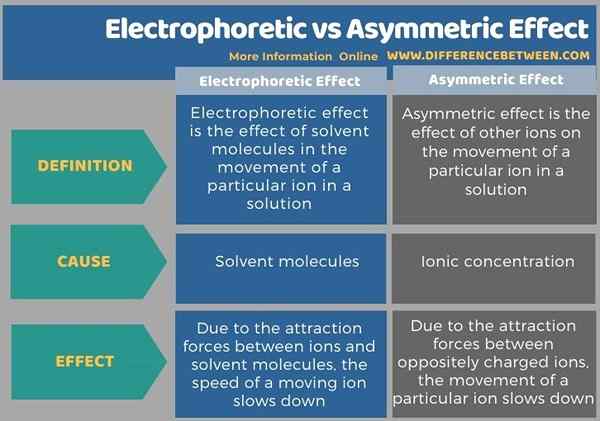
Zusammenfassung -elektrophoretischer gegen asymmetrischer Effekt
Die Begriffe der elektrophoretischen Wirkung und der asymmetrische Effekt werden unter dem Thema „Elektrolytische Leitfähigkeit“ diskutiert. Der Schlüsselunterschied zwischen elektrophoretischer und asymmetrischer Wirkung besteht darin, dass die elektrophoretische Wirkung die Wirkung der Anziehungskräfte zwischen Ionenspezies und Lösungsmittelmolekülen auf die Bewegung von Ionen ist.
Referenz:
1. „Ionische Atmosphäre.” Wikipedia, Wikimedia Foundation, 21. Oktober. 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "GelelelektrophoreseApparatur" (CC BY-SA 3.0) über Commons Wikimedia


