Unterschied zwischen elektropositiv und elektronegativ
Der Schlüsselunterschied zwischen elektropositiv und elektronegativ ist das Elektropositiv bezieht sich auf die Fähigkeit, Elektronen zu verlieren, Kationen zu bilden, während sich elektronegativ auf die Fähigkeit bezieht, Elektronen zu gewinnen, Anionen zu bilden.
Die Begriffe elektropositiv und elektronegativ sind mit der Anziehungskraft oder Abstoßung chemischer Elemente in Richtung Elektronen. Wir können chemische Elemente nach dieser Eigenschaft kategorisieren. Entweder verlieren sie während einer chemischen Reaktion Elektronen oder gewinnen Elektronen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist elektropositiv
3. Was ist elektronegativ
4. Seite an Seite Vergleich - Elektropositiv gegenüber elektronegativen tabellarischen Form
5. Zusammenfassung
Was ist elektropositiv?
Elektropositive Mittelwerte chemische Elemente verlieren dazu, Elektronen zu verlieren. Elektronenverlust bilden Kationen oder positiv geladene Ionen bei chemischen Reaktionen. Es ist ein Maß für die Fähigkeit eines Elements, Elektronen zu spenden. Elemente verlieren tendenziell ihre Elektronen, um eine edle Gaselektronenkonfiguration zu erhalten.
Normalerweise werden alle Metalle als elektropositive chemische Elemente angesehen, da sie leicht abnehmbare Elektronen in ihren äußersten Orbitalen haben. Unter ihnen sind die alkalischen Metalle (chemische Elemente der Gruppe 1) die elektropositivsten Elemente. Theoretisch ist Francium das elektropositive chemische Element, obwohl es in der Natur instabil ist. Obwohl Wasserstoff in der Gruppe1 des Periodenzüchtertabels liegt, kann sie entweder Elektronen verlieren oder gewinnen. Daher können wir es sowohl unter elektropositive als auch unter elektronegative Elemente kategorisieren.
Was ist elektronegativ?
Elektronegativ bezieht sich auf die Fähigkeit eines chemischen Elements, Elektronen zu gewinnen. Das Gewinn von Elektronen von außen bildet Anionen; Anionen sind die negativ geladenen chemischen Spezies. Elektronegativität ist das Gegenteil von Elektropositivität. Das Symbol für dieses Phänomen ist χ. Der Begriff kann sich auf die Anziehungskraft eines gemeinsamen Elektronenpaares oder auf eine Elektronendichte auf sich selbst beziehen. Es gibt zwei Hauptfaktoren, die die Elektronegativität eines chemischen Elements beeinflussen: Atomzahl und Abstand zwischen Kern- und Valenzelektronen.

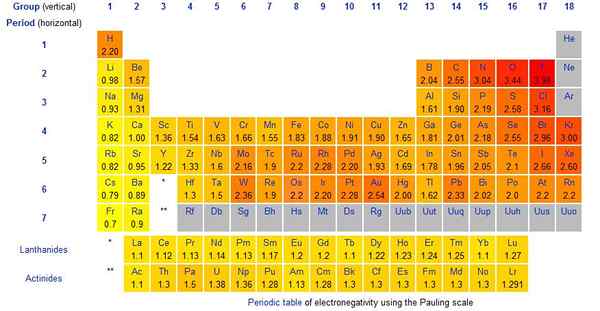
Abbildung 01: Pauling -Skalierungswerte für chemische Elemente
Die Pauling -Skala ist die Methode, mit der wir die Elektronegativität eines chemischen Elements einen Wert geben. Die Skala wurde von Linus Pauling vorgeschlagen. Es ist eine dimensionslose Menge. Darüber hinaus handelt es sich um eine relative Skala, die die Elektronegativitätsbereiche von 0 berücksichtigt.79 bis 3.98. Die Elektronegativität von Wasserstoff beträgt 2.20. Das elektronegativste Element ist Fluor, und sein Pauling -Skala -Wert beträgt 3 3.98 (Normalerweise nehmen wir es als 4). Normalerweise sind alle Halogene (Gruppe 7 Elemente) stark elektronegativ.
Was ist der Unterschied zwischen elektropositiv und elektronegativ?
Der Hauptunterschied zwischen elektropositiv und elektronegativ besteht darin, dass der Begriff elektropositiv auf die Fähigkeit bezieht, Elektronen zu verlieren, Kationen zu bilden. Bei der Betrachtung der chemischen Elemente oben in der Liste in elektropositiven Elementenliste ist das elektropositive Element in der Liste der elektropositiv.
Die Paulingskala ist die Skala, die wir für jedes elektropositive und elektronegative Element einen Wert geben. Diese Skala ergibt jedoch die Elektronegativität eines Elements; Daher können wir feststellen, dass ein sehr niedriger Elektronegativitätswert angibt, dass das Element elektropositiver ist.
Die folgende Infografik fasst den Unterschied zwischen elektropositiv und elektronegativ zusammen.

Zusammenfassung -Elektropositiv gegen elektronegativ
Die Begriffe elektropositiv und elektronegativ beschreiben die Anziehungskraft oder Abstoßung chemischer Elemente gegenüber Elektronen. Der wichtigste Unterschied zwischen elektropositiv und elektronegativ besteht darin, dass der Begriff elektropositiv auf die Fähigkeit bezieht, Elektronen zu verlieren, die Kationen bilden.
Die Paulingskala ist die Skala, die wir für jedes elektropositive und elektronegative Element einen Wert geben. Die Skala gibt die Elektronegativität eines Elements an; Daher können wir feststellen, dass ein sehr niedriger Elektronegativitätswert angibt, dass das Element elektropositiver ist.
Referenz:
1.„Elektronegativität.Wikipedia, Wikimedia Foundation, 13. September. 2019, hier erhältlich.
2. „Warum Metalle als elektropositive Elemente ynosb3SS -Chemistry bezeichnet.”TOPPERLEARNING, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Elektronegativ" von Adblocker - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia


