Unterschied zwischen Enthalpie der Atomisierung und Bindungsdissoziation
Der Schlüsselunterschied Zwischen der Enthalpie der Atomisierung und der Dissoziation der Bindungen ist das Enthalpie der Atomisierung beschreibt die Energie, die erforderlich ist, um ein Molekül in seine Atome zu trennen, während die Enthalpie der Bindungsdissoziation die Dissoziation chemischer Bindungen in einem Molekül beschreibt.
Manchmal ist die Enthalpie der Atomisierung und Enthalpie der Bindungsdissoziation für einige einfache Verbindungen gleich, wenn einfache Bindungen vorhanden sind. Dies liegt daran, dass in einfachen Verbindungen die Dissoziation von Bindungen die Atome bildet, aus denen das Molekül besteht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Enthalpie der Atomisierung
3. Was ist Enthalpie der Bindungsdissoziation
4. Seite an Seitenvergleich -Enthalpie der Atomisierung gegen Bindungsdissoziation in tabellarischer Form
5. Zusammenfassung
Was ist Enthalpie der Atomisierung?
Enthalpie der Atomisierung ist die Veränderung der Enthalpie, die beim Trennen einer chemischen Substanz vollständig in seine Atome auftritt. Diese chemische Substanz kann entweder ein chemisches Element oder eine chemische Verbindung sein. Wir können diese Enthalpieänderung als ΔH bezeichnenbei. Während des Atomisierungsvorgangs werden alle Arten von chemischen Bindungen abgebaut und keine gebildet. Daher ist die Enthalpie der Zerstörung immer ein positiver Wert. Der Standard -Enthalpiewert für diese Enthalpieänderung ist „Standardenthalpie der Atomisierung“. Die in diesem Zusammenhang berücksichtigten Standardbedingungen sind die 268.15 k Temperatur und 1 bar Druck.
Zum Beispiel bezieht sich die Enthalpie der Atomisierung für Wassermolekül auf die Energie, die zur Trennung der beiden Wasserstoffatome und des Sauerstoffatoms im Wassermolekül erforderlich ist. Mit anderen Worten, die Enthalpie der Zerstörung für Wasser ist die Summe der Bindungsdissoziationsenergien von zwei O-H-Bindungen. In ähnlicher Weise ist die Enthalpie der Zerstörung für einen elementaren Feststoff die Enthalpie der Sublimation für diese Substanz, da Sublimation die Umwandlung des Feststoffs in ein monoatomisches Gas nach Verdampfen beinhaltet.
Was ist Enthalpie der Bindungsdissoziation?
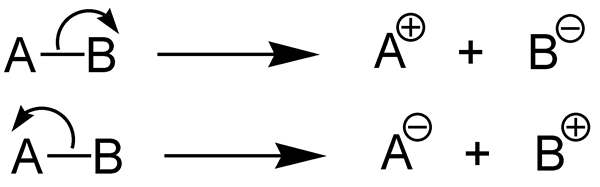
Die Enthalpie der Dissoziation der Bindungen beschreibt die Enthalpieänderung, die während der Dissoziation einer chemischen Bindung auftritt. Mit anderen Worten, es ist das Maß für die Stärke einer chemischen Bindung. Daher können wir sagen, dass eine Standard-Enthalpieänderung, die auftritt, wenn die chemische Bindung A-B durch Hämolyse und Fragmente A und B abbricht, die Enthalpie der Bindungsdissoziation ist. Wenn das Molekül, das wir in Betracht ziehen. Normalerweise sind die A- und B -Fragmente, die durch diese Bindungsdissoziation gegeben wurden. Wir können die Enthalpie der Bindungsdissoziation als DH bezeichnen0.

Es gibt verschiedene Methoden, mit denen wir die Bindungsdissoziation wie die spektrometrische Bestimmung der Energieniveaus, die Erzeugung von Radikalen durch Pyrolyse oder Photolyse, Messungen der chemischen Kinetik und das Gleichgewicht, verschiedene kalorimetrische und elektrochemische Methoden usw.
Was ist der Unterschied zwischen der Enthalpie der Zerstörung und der Dissoziation der Bindungen?
Der Schlüsselunterschied zwischen Enthalpie der Zerstörung und Bindungsdissoziation besteht darin, dass die Enthalpie der Zerstörung die Energie beschreibt. Die Bindungsdissoziationenthalpie und Enthalpie der Atomisierung sind immer positive Werte. Manchmal ist die Enthalpie der Atomisierung und Enthalpie der Bindungsdissoziation für einige einfache Verbindungen gleich, wenn einfache Bindungen vorhanden sind. Diese Begriffe unterscheiden sich jedoch meistens voneinander.
Unterhalb der Infografik -Tabellen mehr Unterschiede zwischen der Enthalpie der Atomisierung und der Dissoziation der Bindungen.
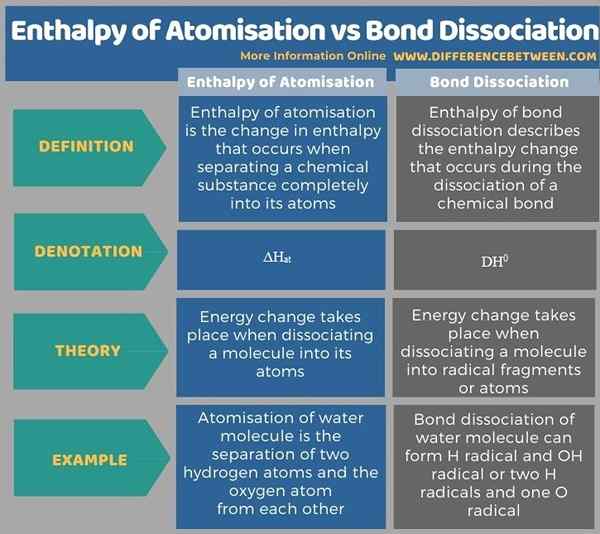
Zusammenfassung -Enthalpie der Atomisierung gegen Bindungsdissoziation
Enthalpie der Atomisierung und Bindungsdissoziation kann für einige einfache Verbindungen synonym verwendet werden, aber nicht immer sind sie gleichwertig. Der Schlüsselunterschied zwischen Enthalpie der Zerstörung und Bindungsdissoziation besteht darin, dass die Enthalpie der Zerstörung die Energie beschreibt.
Referenz:
1. „Enthalpie der Atomisierung.”Wikipedia, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Heterolyse (Chemie)" von Jürgen Martens - Jürgen Martens (CC BY -SA 3.0) über Commons Wikimedia


