Differenz zwischen Gleichgewichtskonstante und Bildungskonstante
Der Schlüsselunterschied Zwischen Gleichgewichtskonstante und Bildungskonstante ist das Die Gleichgewichtskonstante ist das Verhältnis zwischen den Produktkonzentrationen und den Konzentrationen von Reaktanten im Gleichgewicht, während die Bildungskonstante die Gleichgewichtskonstante für die Bildung einer Koordinationsverbindung aus ihren Komponenten ist.
Die Gleichgewichtskonstante ist nützlich, um das Verhalten verschiedener Gleichgewichtszustände zu erklären. Bildungskonstante ist eine Art von Gleichgewichtskonstante, die für die Bildung einer Koordinationsverbindung spezifisch ist. Zum Beispiel komplexes Ion.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Gleichgewichtskonstante
3. Was ist Bildungskonstante
4. Seite für Seitenvergleich - Gleichgewichtskonstante gegen Bildungskonstante in tabellarischer Form
5. Zusammenfassung
Was ist Gleichgewichtskonstante?
Gleichgewichtskonstante ist das Verhältnis zwischen den Produktkonzentrationen und den Konzentrationen von Reaktanten im Gleichgewicht. Dieser Begriff wird nur mit Reaktionen verwendet, die im Gleichgewicht enthalten sind. Der Reaktionsquotient und die Gleichgewichtskonstante sind für Reaktionen, die sich im Gleichgewicht befinden.
Die Gleichgewichtskonstante wird auch als die Konzentrationen angegeben. Die Gleichgewichtskonstante hängt von der Temperatur des betrachteten Systems ab, da die Temperatur die Löslichkeit von Komponenten und die Volumenerweiterung beeinflusst. Die Gleichung der Gleichgewichtskonstante enthält jedoch keine Details zu Festkörpern, die zu den Reaktanten oder den Produkten gehören. Nur die Substanzen in der flüssigen Phase und der gasförmigen Phase werden berücksichtigt.
Betrachten wir beispielsweise das Gleichgewicht zwischen Kohlensäure- und Bicarbonat -Ion.
H2CO3 (aq) ↔ HCO3- (aq) + H+ (aq)
Die Gleichgewichtskonstante für die obige Reaktion ist wie unten angegeben.
Gleichgewichtskonstante (k) = [HCO3- (aq)] [H+ (aq)] / [H2CO3 (aq)]

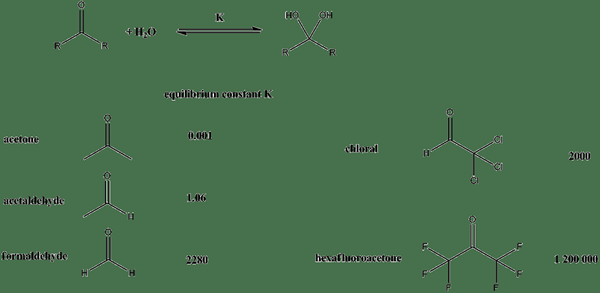
Abbildung 01: Gleichgewichtskonstanten für verschiedene Verbindungen, wenn sie sich in wässrigen Lösungen befinden
Was ist Bildungskonstante?
Bildungskonstante ist die Gleichgewichtskonstante für die Bildung eines Koordinatenkomplexes aus seinen Komponenten in einer Lösung. Wir können es als KF bezeichnen. Dieses Gleichgewicht wird hauptsächlich für die Bildung komplexer Ionen angewendet. Die Komponenten, die wir für die Bildung eines komplexen Ions benötigen, sind Metallionen und Liganden.
Ein komplexes Ion bildet sich infolge von Lewis-Säure-Base-Wechselwirkungen von Metallionen und Liganden. Das Metallionen trägt immer eine positive Ladung und wirkt als Lewis -Säure, während der Ligand ein oder mehrere einsame Elektronenpaare tragen sollte, um als Lewis -Basis zu fungieren. Kleine Metallionen haben eine große Tendenz, komplexe Ionen zu bilden, da sie eine hohe Ladungsdichte haben.
Im Allgemeinen ist die komplexe Ionenbildung eine schrittweise Reaktion, die alle Schritte enthält, die bei der Zugabe von Liganden nacheinander verbunden sind. Somit haben diese Schritte auch individuelle Gleichgewichtskonstanten. Zum Beispiel hat die Bildung von Kupfer-Ammonium-Komplexion vier Schritte. Daher hat es vier verschiedene Gleichgewichtskonstantenwerte: K1, K2, K3 und K4. Dann lautet die Bildungskonstante für die Gesamtreaktion wie folgt:
KF = K1K2K3K4
Was ist der Unterschied zwischen Gleichgewichtskonstante und Bildungskonstante?
Die Gleichgewichtskonstante ist nützlich, um das Verhalten verschiedener Gleichgewichtszustände zu erklären, während die Bildungskonstante eine Art von Gleichgewichtskonstante ist. Der Schlüsselunterschied zwischen Gleichgewichtskonstante und Bildungskonstante besteht darin.
Die folgende Infografik fasst die Differenz zwischen Gleichgewichtskonstante und Bildungskonstante zusammen.
Zusammenfassung -Gleichgewichtskonstante gegen Bildungskonstante
Die Gleichgewichtskonstante ist nützlich, um das Verhalten verschiedener Gleichgewichtszustände zu erklären, während die Bildungskonstante eine Art von Gleichgewichtskonstante ist. Der Schlüsselunterschied zwischen Gleichgewichtskonstante und Bildungskonstante besteht darin.
Referenz:
1. „17.3: Die Bildung komplexer Ionen.”Chemistry Libretexten, Libretexte, 17. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Hydratationks" von Nikolaivica - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


