Differenz zwischen Gleichgewichtskonstante und Geschwindigkeitskonstante
Der Schlüsselunterschied zwischen Gleichgewichtskonstante und Geschwindigkeitskonstante ist, dass die Die Gleichgewichtskonstante wird sowohl unter Verwendung der Konzentrationen von Reaktanten als auch von Produkten exprimiert, während die Geschwindigkeitskonstante entweder unter Verwendung von Reaktanten oder Produkten exprimiert wird.
Beide sind die Gleichgewichtskonstante und die Geschwindigkeitskonstante konstante Werte für eine bestimmte Reaktion. Das bedeutet bei einer konstanten Reaktion, die Bedingungen wie Temperatur, Wert der Gleichgewichtskonstante und die Geschwindigkeitskonstante ändern sich nicht mit der Zeit. Darüber hinaus müssen wir bei der Expression der Gleichgewichtskonstante auch den stöchiometrischen Koeffizienten berücksichtigen. Für die Geschwindigkeitskonstante müssen wir jedoch den Wert nur anhand einer experimentellen Methode bestimmen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Gleichgewichtskonstante
3. Was ist die Geschwindigkeitskonstante
4. Seite an Seitenvergleich - Gleichgewichtskonstante vs. Geschwindigkeitskonstante in tabellarischer Form
5. Zusammenfassung
Was ist Gleichgewichtskonstante?
Die Gleichgewichtskonstante ist das Verhältnis zwischen den Produktkonzentrationen und den Konzentrationen von Reaktanten im Gleichgewicht. Wir können diesen Begriff nur mit Reaktionen im Gleichgewicht verwenden. Der Reaktionsquotient und die Gleichgewichtskonstante sind für Reaktionen, die sich im Gleichgewicht befinden.
Darüber hinaus müssen wir diese Konstante unter Verwendung der Konzentrationen geben, die zur Kraft stöchiometrischer Koeffizienten angehoben werden. Die Gleichgewichtskonstante hängt von der Temperatur des Systems ab, da die Temperatur die Löslichkeit von Komponenten und die Volumenausdehnung beeinflusst. Die Gleichung für die Gleichgewichtskonstante enthält jedoch keine Details zu Festkörpern, die zu den Reaktanten oder Produkten gehören. Nur die Substanzen in der flüssigen Phase und der gasförmigen Phase werden berücksichtigt.
Zum Beispiel ist das Gleichgewicht zwischen Essigsäure und Acetation wie folgt:
CH3Cooh ⇌ ch3GURREN- + H+
Die Gleichgewichtskonstante KC für diese Reaktion lautet wie folgt:
KC = [CH3GURREN-][ H+]/[CH3Cooh]

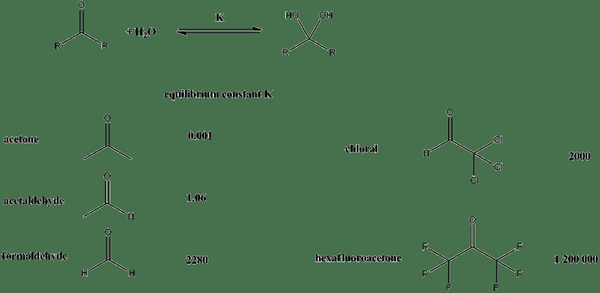
Abbildung 01: Gleichgewichtskonstanten für verschiedene Verbindungen
Was ist die Geschwindigkeitskonstante?
Die Geschwindigkeitskonstante ist ein Verhältnismäßigkeitskoeffizient, der die Geschwindigkeit einer chemischen Reaktion bei einer bestimmten Temperatur auf die Konzentration der Reaktanten oder der Reaktionsprodukte bezieht. Wenn wir die Geschwindigkeitsgleichung in Bezug auf den Reaktanten A für die nachstehend angegebene Reaktion schreiben, ist sie wie folgt.
aa + bb ⟶ cc + dd
R = -k [a] a [b] b
In dieser Reaktion ist k die Geschwindigkeitskonstante. Es ist eine Verhältnismäßigkeitskonstante, die von der Temperatur abhängt. Wir können die Geschwindigkeit und die Geschwindigkeitskonstante einer Reaktion durch Experimente bestimmen.
Was ist der Unterschied zwischen Gleichgewichtskonstante und Geschwindigkeitskonstante?
Der Schlüsselunterschied zwischen Gleichgewichtskonstante und Geschwindigkeitskonstante besteht darin, dass die Gleichgewichtskonstante sowohl unter Verwendung der Konzentrationen von Reaktanten als auch von Produkten exprimiert wird, während die Geschwindigkeitskonstante entweder unter Verwendung der Konzentration der Reaktanten oder Produkte ausgedrückt wird. Darüber hinaus ist die Gleichgewichtskonstante für eine Gleichgewichtsreaktion angegeben, während die Geschwindigkeitskonstante für jede Reaktion angegeben werden kann.
Darüber hinaus können wir bei der Expression der Gleichgewichtskonstante die Konzentrationen von Reaktanten und Produkten zusammen mit den stöchiometrischen Koeffizienten verwenden, während wir bei der Expression der Geschwindigkeitskonstante den stöchiometrischen Koeffizienten nicht verwenden können, da wir den Wert des Konstanten experimentell bestimmen müssen. Außerdem beschreibt die Gleichgewichtskonstante ein unveränderliches Reaktionsgemisch, während die Geschwindigkeitskonstante ein Reaktionsgemisch beschreibt, das sich mit der Zeit ändert.
Zusammenfassung -Gleichgewichtskonstante vs. Geschwindigkeitskonstante
Zusammenfassend ändern sich beide die Gleichgewichtskonstante und die Geschwindigkeitskonstante nicht mit der Zeit, wenn die Reaktionsbedingungen wie die Temperatur nicht geändert werden. Der Schlüsselunterschied zwischen Gleichgewichtskonstante und Geschwindigkeitskonstante besteht jedoch darin, dass die Gleichgewichtskonstante sowohl unter Verwendung der Konzentrationen von Reaktanten als auch von Produkten exprimiert wird, während die Geschwindigkeitskonstante entweder unter Verwendung der Konzentration von Reaktanten oder Produkten exprimiert wird.
Referenz:
1. Helmenstine, Anne Marie. „Was ist die Geschwindigkeitskonstante in der Chemie??”Thoughtco, Sep. 27, 2018, hier erhältlich.
2. „Die Gleichgewichtskonstante, k.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Hydratationks.”Von Nikolaivica - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


