Unterschied zwischen Äquivalenzpunkt und Endpunkt
Der Schlüsselunterschied Zwischen Äquivalenzpunkt und Endpunkt befindet sich die Äquivalenzpunkt in einer Titration ist der Punkt, an dem der zugesetzte Titrant chemisch vollständig mit dem Analyten in der Probe äquivalent ist, während der Endpunkt der Punkt ist, an dem der Indikator seine Farbe ändert.
Die Titration ist eine Technik, die wir in der analytischen Chemie umfassend verwenden, um Säuren, Basen, Oxidationsmittel, Reduktionsmittel, Metallionen und viele andere Spezies zu bestimmen. In einer Titration findet eine chemische Reaktion statt. Hier reagiert ein Analyten mit einem Standardreagenz, das wir als Titrant bezeichnen. Manchmal verwenden wir einen primären Standard, der eine hoch gereinigte und stabile Lösung ist, als Referenzmaterial bei titrimetrischen Methoden. Wir verwenden einen Indikator, um den Endpunkt der Reaktion zu erkennen. Es ist jedoch nicht der tatsächliche Punkt, an dem die chemische Reaktion endet. Der tatsächliche Punkt ist der Äquivalenzpunkt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Endpunkt
3. Was ist Äquivalenzpunkt
4. Seite für Seitenvergleich - Äquivalenzpunkt vs Endpunkt in tabellarischer Form
5. Zusammenfassung
Was ist Endpunkt?
In jeder Titration ist Endpunkt der Punkt, an dem der Indikator seine Farbe ändert. Oder wir können eine Änderung einer instrumentellen Antwort verwenden, um den Endpunkt zu identifizieren. Zum Beispiel reagieren HCl und NaOH 1: 1 und produzieren NaCl und Wasser. Für diese Titration können wir den Phenolphthalein -Indikator verwenden, der eine rosa Farbe im Basismedium hat und im sauren Medium farblos wird. Wenn wir HCL in den Titrationskolben und dazu bringen, wenn wir einen Tropfen Phenolphthalein hinzufügen, wird es farblos.

Abbildung 02: Endpunkt ist der Farbwechselpunkt
Während der Titration können wir Naoh aus der Burette hinzufügen und allmählich werden HCl und Naoh im Kolben reagieren. Wenn wir die gleiche Konzentration der beiden Lösungen einnehmen, wird die Lösung im Kolben in einer hellrosa Farbe, wenn wir dem Kolben eine gleiche Menge NaOH hinzufügen, zu einer hellrosa Farbe verwandelt. Dies ist der Punkt, an dem wir die Titration stoppen (Endpunkt). Wir sind an diesem Punkt der Reaktion abgeschlossen.
Was ist Äquivalenzpunkt?
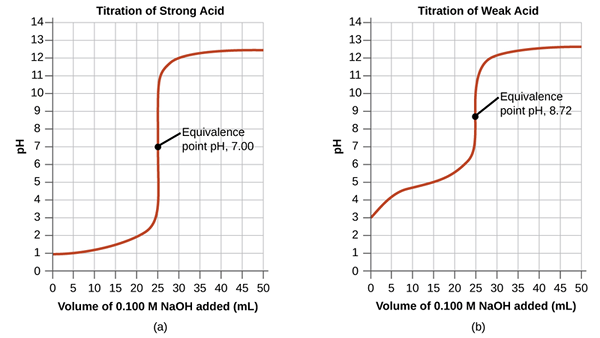
Der Äquivalenzpunkt in einer Titration ist der Punkt, an dem der zugesetzte Titrant chemisch vollständig mit dem Analyten in der Probe äquivalent ist. Dies ist der Punkt, an dem die chemische Reaktion stöchiometrisch abgeschlossen wird.

Abbildung 01: Äquivalenzpunkte für starke Säure und schwache Säure -Titration
Obwohl wir den Endpunkt aus der Indikator -Farbänderung bestimmen, ist es die meiste Zeit nicht den tatsächlichen Endpunkt der Reaktion. Die Reaktion wird vor diesem Punkt geringfügig abgeschlossen. An diesem Äquivalenzpunkt ist das Medium neutral. In dem im vorherigen Abschnitt diskutierten Beispiel nach dem Hinzufügen eines zusätzlichen NaOH -Tropfens zeigt das Medium die Grundfarbe von Phenolphthalein, die wir als Endpunkt betrachten.
Was ist der Unterschied zwischen Äquivalenzpunkt und Endpunkt?
Äquivalenzpunkt in einer Titration ist der Punkt, an dem der zugesetzte Titrant chemisch vollständig mit dem Analyten in der Probe äquivalent ist, während der Endpunkt der Punkt ist, an dem der Indikator seine Farbe ändert. Dies ist der Hauptunterschied zwischen Äquivalenzpunkt und Endpunkt. Darüber hinaus kommt der Äquivalenzpunkt immer vor dem Endpunkt der Titration.

Zusammenfassung - Äquivalenzpunkt gegen Endpunkt
In jeder Titration haben wir zwei wichtige Punkte; nämlich den äquivalenten Punkt und Endpunkt der Titration. Der Schlüsselunterschied zwischen Äquivalenzpunkt und Endpunkt besteht darin, dass der Äquivalenzpunkt in einer Titration der Punkt ist, an dem der zugeordnete Titrant chemisch vollständig mit dem Analyten in der Probe äquivalent ist, während der Endpunkt der Punkt ist, an dem der Indikator seine Farbe ändert.
Referenz:
1. "Äquivalenzpunkt.Wikipedia, Wikimedia Foundation, 15. April. 2018. Hier verfügbar
2. Libretexten. „Titration Fundamentals.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”CNX Chem 14 07 Titration” von OpenStax (CC von 4.0) über Commons Wikimedia
2.”Phenolphthalein in Flask“ von 384 - eigene Arbeit, (CC BY -SA 4.0) über Commons Wikimedia


