Unterschied zwischen Ethan -Ethen und Ethyne
Der Hauptunterschied zwischen Ethan -Ethen und Ethyne ist das Ethane hat sp3 hybridisierte Kohlenstoffatome und Ethen hat sp2 -hybridisierte Kohlenstoffatome, während Ethyne SP -hybridisierte Kohlenstoffatome hat.
Ethan, Ethen und Ethyne sind wichtige Kohlenwasserstoffe, die in Rohöl und Erdgasen zu finden sind. All dies sind gasförmige Verbindungen, weil sie sehr kleine Moleküle sind.

INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ethan
3. Was ist Ethen
4. Was ist Ethyne
5. Ähnlichkeiten zwischen Ethan -Ethen und Ethyne
6. Seite an Seitenvergleich - Ethan -Ethen gegen Ethyne in tabellarischer Form
7. Zusammenfassung
Was ist Ethan?
Ethan ist eine organische Verbindung mit der chemischen Formel C2H6. Es ist das zweit einfachste Alkan. Ein Alkan ist eine organische Verbindung mit nur Sigma -Bindungen zwischen Atomen. Daher hat Ethan nur einzelne Bindungen in seiner chemischen Struktur; Somit ist es eine gesättigte Verbindung.

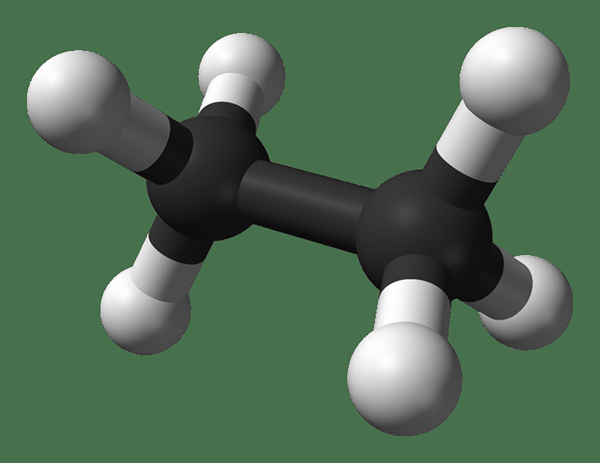
Abbildung 1: Chemische Struktur von Ethan
Die Kohlenstoffatome des Ethanmoleküls sind sp3 hybridisierte Kohlenstoffatome. Dies bedeutet. Die Geometrie um ein Kohlenstoffatom ist somit tetraedrisch. Jedes Kohlenstoffatom hat drei Wasserstoffatome, die über einzelne Bindungen gebunden sind.
Einige chemische Fakten über Ethane
- Chemische Formel = C2H6
- Molmasse = 30.07 g/mol
- Physischer Zustand bei Raumtemperatur = farbloses Gas
- Geruch = geruchlos
- Schmelzpunkt = -182.8 ° C
- Siedepunkt = –88.5 ° C
Die häufigste Verwendung von Ethan besteht darin, Ethen durch Dampf -Crack -Prozess zu produzieren. Darüber hinaus ist Ethan ein Kältemittel, das in kryogenen Kühlsystemen verwendet wird.
Was ist Ethen?
Ethen ist eine organische Verbindung mit der chemischen Formel C2H4. Der gebräuchliche Name dieser Verbindung ist Ethylen. Es gibt eine doppelte Bindung zwischen den beiden Kohlenstoffatomen: eine Sigma -Bindung und eine PI -Bindung. Daher ist die Hybridisierung der Kohlenstoffatome in diesem Molekül die Sp2 -Hybridisierung. Somit ist die Geometrie um ein Kohlenstoffatom planar, und es gibt unhybridisierte P-Orbitale in Kohlenstoffatomen. Dies macht das gesamte Molekül zu einem planaren Molekül. Da es eine Doppelbindung gibt, ist Ethen ein ungesättigter Molekül.
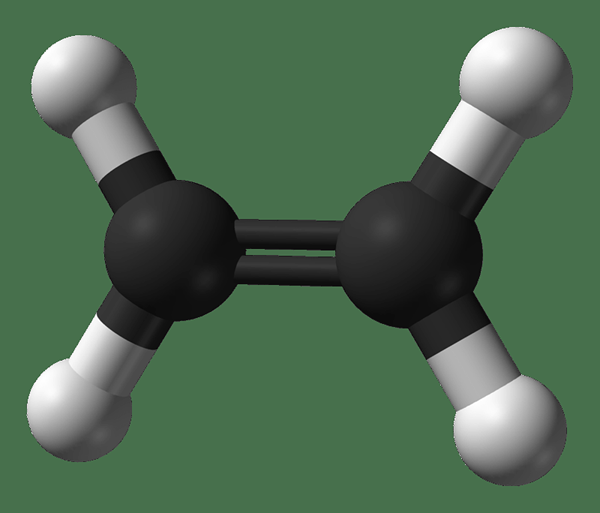
Abbildung 2: Chemische Struktur von Ethen
Einige chemische Fakten über Ethen
- Chemische Formel = C2H4.
- Molmasse = 28.05 g/mol
- Physischer Zustand bei Raumtemperatur = farblos, brennbares Gas
- Geruch = ein charakteristischer süßer Geruch
- Schmelzpunkt = -169.2 ° C
- Siedepunkt = –103.7 ° C
Die in diesem Molekül vorhandene Doppelbindung verursacht die Reaktivität dieser Verbindung. Darüber hinaus wird Ethen als Monomer für die Herstellung von Polymeren wie Polyethylen über Additionspolymerisation verwendet. Abgesehen davon ist Ethen ein Pflanzenhormon, das die Fruchtreife regulieren kann.
Was ist Ethyne?
Ethyne ist eine organische Verbindung mit der chemischen Formel C2H2. Der gebräuchliche Name dieser Verbindung ist Acetylen. Es hat eine dreifache Bindung zwischen den beiden Kohlenstoffatomen: eine Sigma -Bindung und zwei PI -Bindungen. Daher gibt es in diesen Kohlenstoffatomen keine nicht hybridisierten P-Orbitale. Jedes Kohlenstoffatom hat ein Wasserstoffatom über eine einzelne Bindung gebunden. Die Geometrie des Moleküls ist linear und die Struktur ist planar.
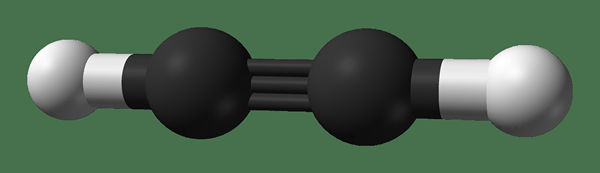
Abbildung 3: Chemische Struktur von Ethänien
Einige chemische Fakten über Ethylen
- Chemische Formel = C2H2.
- Molmasse = 26.04 g/mol
- Physischer Zustand bei Raumtemperatur = farblos, brennbares Gas
- Geruch = geruchlos
- Schmelzpunkt = –80.8 ° C (dreifacher Punkt der Acetylen)
- Siedepunkt = –84 ° C (Sublimationspunkt)
Zuvor wurde Ethyne hauptsächlich durch teilweise Verbrennung von Methan produziert. Der einfachste Prozess der Herstellung von Ethyne ist die Reaktion zwischen Calciumcarbid und Wasser. Die Produkte dieser Reaktion sind Ethynegas und Calciumcarbonat. Dies ist jedoch bei industriellen Anwendungen schwierig, da dies hohe Temperaturen erfordert. Daher verwenden wir die folgenden Techniken in der industriellen Produktion von Ethyne:
- Produktion von Ethyne unter Verwendung von Calciumcarbid unter kontrollierten Bedingungen
- Wärmeknacken von Kohlenwasserstoffen
Was sind die Ähnlichkeiten zwischen Ethan -Ethen und Ethyne??
- Ethanethen und Ethyne sind Kohlenwasserstoffverbindungen
- Ethanethen und Ethyne sind Gase bei Raumtemperatur.
- Alle drei bestehen aus zwei Kohlenstoffatomen.
Was ist der Unterschied zwischen Ethan -Ethen und Ethyne?
Ethane gegen Ethen gegen Ethyne | ||
| Ethan ist eine organische Verbindung mit der chemischen Formel C2H6. | Ethen ist eine organische Verbindung mit der chemischen Formel C2H4. | Ethyne ist eine organische Verbindung mit der chemischen Formel C2H2. |
| Molmasse | ||
| Die Molmasse von Ethan beträgt 30.07 g/mol. | Die Molmasse von Ethen beträgt 28.05 g/mol. | Die Molmasse von Ethyne beträgt 26.04 g/mol. |
| Schmelzpunkt | ||
| Der Schmelzpunkt von Ethan ist -182.8 ° C | Ethen hat einen Schmelzpunkt von -169.2 ° C. | Der Schmelzpunkt von Ethyne beträgt –80.8 ° C. |
| Geometrie | ||
| Die Geometrie von Ethan ist tetraedrisch. | Ethene hat eine planare Geometrie. | Die Geometrie von Ethyne ist linear. |
| Hybridisierung von Kohlenstoffatomen | ||
| Kohlenstoffatome von Ethan werden SP3 hybridisiert. | Ethen hat Kohlenstoffatome, die sp2 hybridisiert werden. | Carbon -Atome von Ethyne werden SP -hybridisiert. |
| Geruch | ||
| Ethane ist geruchlos. | Ethen hat einen charakteristischen süßen Geruch. | Ethyne ist geruchlos. |
Zusammenfassung - Ethane gegen Ethen gegen Ethyne
Ethan, Ethen und Ethyne sind kleine Kohlenwasserstoffverbindungen. Daher bestehen diese Verbindungen nur aus Wasserstoff- und Kohlenstoffatomen. Sie unterscheiden sich voneinander, basierend auf der Anordnung der Atome und der in den Molekülen vorhandenen chemischen Bindungen. Der Hauptunterschied zwischen Ethanethen und Ethyne besteht darin, dass Ethan sp3 hybridisierte Kohlenstoffatome und Ethen sp2 hybridisierte Kohlenstoffatome hat, während Ethyne SP -hybridisierte Kohlenstoffatome hat.
Referenz:
1. „Ethan.”Wikipedia, Wikimedia Foundation, 14. April. 2018, hier erhältlich.
2. Lazonby, John. „Ethen (Ethylen).”Die wesentliche chemische Industrie online, hier verfügbar.
3. „Ethylen.”Wikipedia, Wikimedia Foundation, 18. April. 2018, hier erhältlich.
4. "Acetylen.”Wikipedia, Wikimedia Foundation, 18. April. 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Ethane-A-3D-Balls" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
2. "Ethylen-CRC-MW-3D-Balls" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia
3. "Acetylen-CRC-IR-3D-Balls" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


