Unterschied zwischen Veresterung und Saponifikation
Der Hauptunterschied zwischen Veresterung und Saponifikation ist das Die Veresterung bildet einen Ester, während die Saponifikation Ester in seine Ausgangsmaterialien einbricht.
Ein Ester wird aus einer Carbonsäure und einem Alkohol gebildet. Daher ist die Veresterung die Bildung eines Esters aus einer Carboxsäure und eines Alkohols. Während Saponification die Carboxylsäure und Alkohol bildet, die zur Herstellung des Ester verwendet werden.

INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Veresterung?
3. Was ist Saponifikation
4. Seite für Seitenvergleich - Veresterung gegen Saponifikation in tabellarischer Form
5. Zusammenfassung
Was ist Veresterung??
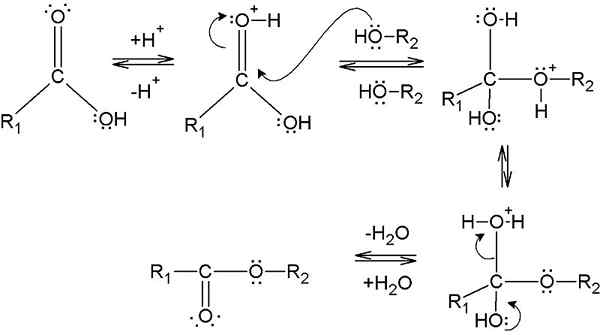
Die Veresterung ist die Bildung eines Esters aus der Reaktion zwischen einer Carboxylsäure und einem Alkohol. Dieser Prozess erfordert einen Katalysator, um die Aktivierungsenergiebarriere der Reaktion zu verringern. Dieser Katalysator ist typischerweise ein saurer Katalysator. Darüber hinaus sollte das Reaktionsgemisch erhitzt werden, da der Veresterungsprozess Energie erfordert (um die C -OH -Bindung von Carboxylsäure zu spalten, um die -OH -Gruppe zu entfernen)).

Abbildung 1: Bildung eines Esters durch Veresterung
Veresterungsprozess beinhaltet die Entfernung der Hydroxylgruppe (-OH) der Carbonsäure und des Wasserstoffatoms der Hydroxylgruppe des Alkohols. Während dieses Prozesses wirkt die -oh -Gruppe aus der Carbonsäure, sie wirkt als Elektrophil. Und wenn das Proton des Alkohols entfernt wird, wirkt es als Nucleophil. Daher greift dieses Nucleophil das aus der Carbonsäure gebildete Elektrophil an und bildet einen Ester. Dies gibt ein Wassermolekül als Nebenprodukt. Somit bildet sich das Wassermolekül aus der Kombination von -OH -Gruppe aus Carboxylsäure und dem Proton aus Alkohol. Daher kann man mit einem Dehydrationsmittel reinen Ester erhalten (um Wasser aus dem Reaktionsgemisch zu entfernen).
Was ist Saponifikation?
Saponifikation ist der Zusammenbruch eines Ester in eine Carbonsäure und einen Alkohol. Es ist das Gegenteil von Esterifikation. Saponifizierung tritt in einem wässrigen Medium in Gegenwart einer Basis auf. Die grundlegenden Bedingungen des Mediums machen das Carboxylatanion stabiler als die Carbonsäureform. Daher trennt sich das Carboxylation vom Ester. Saponifikation kann in Abwesenheit von Wärmeenergie auftreten, da sie keine Energiebarriere hat. Hier liefern die Wassermoleküle im wässrigen Medium h+ Ionen, und die Basis liefert OH- Ionen, die für die Bildung von Alkohol und Carboxylsäure erforderlich sind.
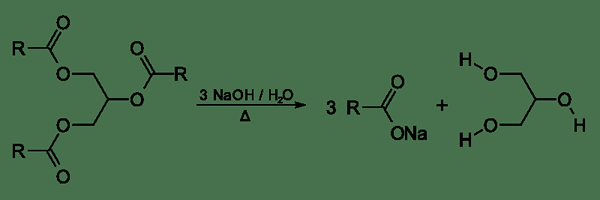
Abbildung 2: Allgemeiner Prozess der Saponifikation
Saponification -Reaktionsmechanismus:
- Nucleophiler Angriff
- Umlagerung
- Entfernung der verlassenen Gruppe
- Deprotonierung
Die Hydroxylionen (OH-) wirken als Nucleophile, da sie reich an Elektronen sind. Diese Ionen können die Esterbindung (-c-o-o-) der Ester angreifen. Sie greifen das Kohlenstoffatom dieser Bindung an, da das Kohlenstoffatom aufgrund des Vorhandenseins von Sauerstoffatomen, die am Kohlenstoffatom gebunden sind, eine teilweise positive Ladung aufweist. Dann bildet das OH -Ion eine kovalente Bindung zum Kohlenstoffatom. Das Kohlenstoffatom können jedoch keine fünf kovalenten Bindungen haben, da es ein instabiler Kohlenstoffzustand ist. Daher findet nach dieser Bindungsbildung ein Neuanordnerschritt statt. Im Umlagerungsschritt werden die Moleküle durch die Entfernung der Gruppe (die aus dem Alkohol stammt, der zur Herstellung des Esters verwendet wurde) stabil). Es ist die verlassene Gruppe der Saponification -Reaktion. Eine Deprotonation der Carboxylsäure findet statt, da das Carboxylation die stabile Form in einem Basismedium ist.
Was ist der Unterschied zwischen Veresterung und Saponifikation?
Veresterung gegen Saponifikation | |
| Die Veresterung ist die Bildung eines Esters aus der Reaktion zwischen einer Carboxylsäure und einem Alkohol. | Saponifikation ist der Zusammenbruch eines Ester in eine Carbonsäure und einen Alkohol. |
| Energiebedarf | |
| Die Veresterung erfordert Energie in Form von Wärme. | Saponifikation erfordert keine externe Energie. |
| Reaktanten | |
| Die Reaktanten der Veresterung sind Alkohol und Carbonsäure. | Die Reaktanten der Saponifikation sind Ester und Basis zusammen mit Wasser. |
| Katalysator | |
| Die Veresterung erfordert einen sauren Katalysator. | Saponifikation erfordert einen Basiskatalysator. |
Zusammenfassung -Veresterung gegen Saponifikation
Veresterung und Saponifizierung sind wichtige chemische Reaktionen in der Chemie. Die Veresterung ist die Estersynthese, und die Saponifizierung ist die Bruch der Esterbindung. Der Hauptunterschied zwischen Veresterung und Saponifizierung besteht darin.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Saponification Definition und Reaktion.”Thoughtco, Oktober. 3, 2017, hier erhältlich.
2. „Saponifikation.”Wikipedia, Wikimedia Foundation, 3. April. 2018, hier erhältlich.
3. Veresterung - Alkohole und Carboxsäuren. Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Esters Formation" von Laghi.l - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "SaponificationGenera" von V8RIK bei English Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


