Unterschied zwischen der ersten und zweiten Ionisationsenergie (I1E vs I2E)
Schlüsselunterschied - Erste gegen zweite Ionisationsenergie (I1E vs I2E)
Bevor wir den Unterschied zwischen der ersten und der zweiten Ionisierungsenergie analysieren, diskutieren wir zunächst, was Ionisationsenergie ist. Im Allgemeinen wird die Ionisierungsenergie als die Energie bezeichnet, die erforderlich ist, um ein Elektron aus einem gasförmigen Atom oder einem Ion zu entfernen. Da Elektronen vom positiven Kern angezogen werden, muss die Energie für diesen Prozess geliefert werden. Dies wird als endothermes Prozess angesehen. Die Ionisationsenergien werden in kJ mol exprimiert-1. Der Schlüsselunterschied Zwischen der ersten und der zweiten Ionisierung Energie wird am besten in ihren Definitionen erklärt; Die Energie, die von einem neutralen, gasförmigen Atom aufgenommen wurde, um ein +1 geladenes Ion zu erzeugen (um ein Elektron zu entfernen) wird genannt Erste Ionisationsenergie wohingegen Die von einem positiv geladene (+1) gasförmige Ion absorbierte Energie, um Ion mit einer Ladung von +2 zu erzeugen wird genannt die zweite Ionisationsenergie. Die Ionisationsenergie wird für 1 Mol Atome oder Ionen berechnet. Mit anderen Worten; Die erste Ionisationsenergie bezieht sich auf neutrale gasförmige Atome und die zweite Ionisationsenergie bezieht. Die Größe der Ionisationsenergie variiert abhängig von der Ladung des Kerns, dem Abstand der Elektronenform des Kern.
Was ist die erste Ionisierungsenergie (ich1E)?
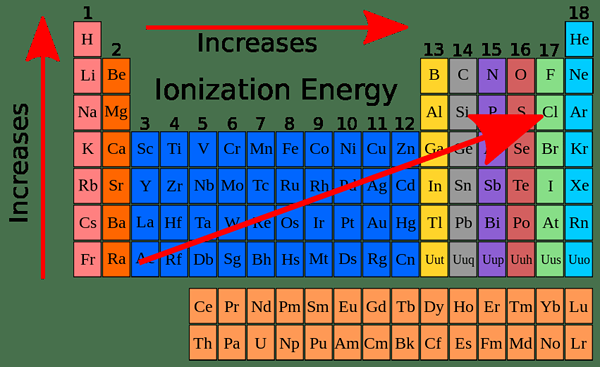
Die erste Ionisationsenergie ist definiert als die von 1 mol neutralen gasförmige Atome absorbierte Energie, um das locker gebundene Elektron aus Atom zu entfernen, um 1 Mol Gasionen mit +1 Ladung zu erzeugen. Die Größe der ersten Ionisationsenergie steigt entlang eines Zeitraums in der Periodenzüchtungstabelle und nimmt entlang einer Gruppe ab. Erste Ionisationsenergie hat Periodizität; Es hat das gleiche Muster wiederholt entlang der Periodenzüchtertabelle.
Was ist die zweite Ionisierungsenergie (i2E)?
Die zweite Ionisationsenergie ist definiert als die von 1 mol positiv geladene gasförmige Ionen absorbierte Energie, um 1 Mol Gasionen mit einer +2 -Ladung zu produzieren, indem das locker gebundene Elektron aus dem +1 Ion entfernt wird. Die zweite Ionisierungsenergie zeigt auch Periodizität. 
Was ist der Unterschied zwischen der ersten und der zweiten Ionisierungsenergie (i1E und ich2E)?
Definition von Erste und zweite Ionisationsenergie
Erste Ionisationsenergie (i1E): Die Energie, die erforderlich ist, um das locker gebundene Elektron aus 1 Mol Gasatomen zu entfernen, um 1 Mol Gasionen mit einer positiven Ladung zu produzieren (+1).
X (G) X+ (G) + e-
(1 mol) (1 mol) (1 mol)
Zweite Ionisationsenergie (i2E): Die Energie, die erforderlich ist, um das locker gebundene Elektron aus 1 Mol Gasionen mit einer Ladung von +1 zu entfernen, um Mol von gasförmigen Ionen mit +2 Ladung zu erzeugen.
X+ (G) X2+ (G) + e-
(1 mol) (1 mol) (1 mol)
Eigenschaften der ersten und zweiten Ionisationsenergie
Energiebedarf
Normalerweise ist es einfacher, das erste Elektron aus einem gasförmigen Atom des Grundzustands zu vertreiben, als das zweite Elektron aus einem positiv geladenen Ion zu vertreiben. deshalb, die Die erste Ionisationsenergie ist geringer als die zweite Ionisationsenergie, und der Energieunterschied zwischen der ersten und der zweiten Ionisationsenergie ist signifikant groß.
| Element | Erste Ionisationsenergie (i1E) /KJ Mol-1 | Zweite Ionisationsenergie (i2E) / KJ Mol-1 |
| Wasserstoff (H) | 1312 | |
| Helium (er) | 2372 | 5250 |
| Lithium (li) | 520 | 7292 |
| Beryllium (BE) | 899 | 1757 |
| Bor (b) | 800 | 2426 |
| Kohlenstoff (c) | 1086 | 2352 |
| Stickstoff (n) | 1402 | 2855 |
| Sauerstoff (o) | 1314 | 3388 |
| Fluor (f) | 680 | 3375 |
| Neon (NE) | 2080 | 3963 |
| Natrium (Na) | 496 | 4563 |
| Magnesium (mg) | 737 | 1450 |
Trends der Ionisationsenergie in der Periodenzüchtertabelle
Erste Ionisationsenergie (i1E): Erste Ionisationsenergiewerte von Atomen in jedem Zeitraum zeigen die gleiche Variation. Die Größe ist immer geringer als die zweiten Ionisationsenergiewerte
Zweite Ionisationsenergie (i2E): Die zweite Ionisationsenergiewerte von Atomen in jedem Zeitraum zeigen die gleiche Variation; Diese Werte sind immer höher als die ersten Ionisationsenergiewerte.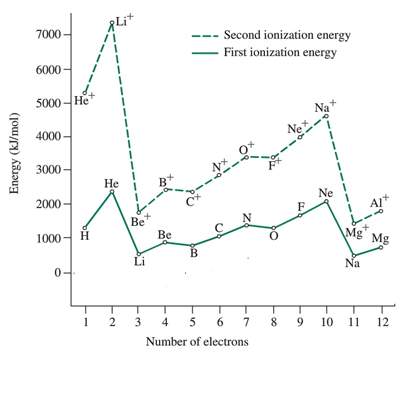 Bild mit freundlicher Genehmigung:
Bild mit freundlicher Genehmigung:


