Unterschied zwischen gesättigter und übersättigter Lösung

Schlüsselunterschied - gesättigtes gegen übersättigte Lösung
Lassen Sie uns zunächst kurz das Konzept der Sättigung betrachten, bevor wir zu einer komplexen Analyse der Differenz zwischen gesättigter und übersättigter Lösung übergehen. Lösungen werden durch Auflösen eines gelösten Stoffes in einem Lösungsmittel durchgeführt. Die beiden chemischen Eigenschaften von „Sättigung“ und „Übersättigung“ in Lösungsmitteln hängen hauptsächlich von der Löslichkeit des gelösten Stoffes im Lösungsmittel ab. Bei einer bestimmten Temperatur ist die Löslichkeit eines gelösten Stoffes in einem bestimmten Lösungsmittel eine Konstante (q).
Q ist definiert als das Ionenprodukt des gelösten Stoffes.
Beispiel: Löslichkeit von AgCl in Wasser (qAgcl) = [Ag+] [Cl-]
Wenn wir den gelösten Stoff weiter in das Lösungsmittel hinzufügen, gibt es im Allgemeinen eine maximale Menge, die wir im Lösungsmittel auflösen können. Nach einer bestimmten Grenze beginnt der gelöste Stoff im Lösungsmittel zu schließen. Es wird nach dieser Grenze zu einer übersättigten Lösung. Es wird als gesättigte Lösung bezeichnet, wenn wir den gelösten Stoff ohne Bildung eines Niederschlags auflösen können.
Der Schlüsselunterschied zwischen Sättigung und Übersättigung ist das, Sättigung ist der Zustand, in dem eine Lösung einer Substanz nicht mehr von dieser Substanz auflösen kann, und zusätzliche Mengen davon werden als separate Phase auftreten, während die Übersättigung ein Zustand einer Lösung ist, die mehr vom gelösten Materie enthält, als durch gelöst werden könnte durch das Lösungsmittel unter normalen Umständen.
Was ist eine gesättigte Lösung?
Es gibt eine sehr begrenzte Anzahl von Verbindungen, die in einem Lösungsmittel unendlich löslich sind. Das heißt, wir können den gelösten Stoff im Lösungsmittel in jedem Verhältnis mischen, um sich aufzulösen, ohne einen Niederschlag zu bilden. Die meisten gelösten Stoffe sind jedoch nicht unlöslich; Sie bilden einen Niederschlag, wenn Sie dem Lösungsmittel mehr gelösten Stoff aufnehmen.
Gesättigte Lösungen enthalten die maximale Anzahl von gelösten Molekülen, die sie ohne Niederschlag auflösen können.
Was ist eine übersättigte Lösung?
Übersättigte Lösungen werden gebildet, wenn Sie der gesättigten Lösung zusätzlichen gelösten gelösten Stoff hinzufügen. Mit anderen Worten, es ist der Zustand in einer gesättigten Lösung, wenn Sie eine zusätzliche Menge an gelösten Stoff in die Lösung hinzufügen. Dann wird es beginnt, einen Niederschlag in der Lösung zu bilden, da das Lösungsmittel die maximale Menge an gelösten Molekülen überschritten hat, die es auflösen kann. Wenn Sie die Temperatur des Lösungsmittels erhöhen, können Sie eine gesättigte Lösung erstellen, indem Sie die gelösten Moleküle auflösen.

Die Übersättigung von Zucker in Wasser ermöglicht die Bildung von Gesteins Süßigkeiten.
Was ist der Unterschied zwischen gesättigter und übersättigter Lösung?
Definition der gesättigten und übersättigten Lösung
Gesättigte Lösung: Bei einer bestimmten Temperatur soll eine Lösung eine gesättigte Lösung sein, wenn sie so viel wie gelöste Moleküle enthält, die das Lösungsmittel halten kann.
Übersättigte Lösung: Bei einer bestimmten Temperatur soll eine Lösung eine übersättigte Lösung sein, wenn sie mehr gelöste Moleküle enthält, die sie auflösen kann.
Chemische Erklärung
Für gesättigte Lösungen; Q = ksp (Kein Niederschlag)
Für Übersättigte Lösungen; Q> ksp (Niederschlag bildet)
Wo;
Q = Löslichkeit (Reaktionsquotient)
K sp= Löslichkeitsprodukt (mathematisches Produkt gelöster Ionenkonzentrationen, die zur Macht ihrer stöchiometrischen Koeffizienten angehoben werden)
Beispiel: Erwägen Sie, Silberchlorid (AGCL) in Wasser aufzulösen.
Agcl - gelöster und Wasser - Lösungsmittel

AGCL hat sich in Wasser aufgelöst. Eine große Menge an Agcl hat sich in Wasser aufgelöst.
Die Lösung ist klar, dass der Niederschlag deutlich sichtbar ist
Q = [AG+] [Cl-] = Ksp Q = [AG+] [Cl-]> Ksp
Wo,
[AG+] = Konzentration von Ag+ im Wasser
[Cl-] = Konzentration von CL- im Wasser
Für Agcl, ksp = 1.8 × 10-10 Mol2dm-6
Wie können wir gesättigte und übersättigte Lösungen machen??
Sowohl gesättigte als auch übersättigte Lösungen werden gebildet, wenn Sie immer wieder einen bestimmten Stoff in ein Lösungsmittel hinzufügen. Bei einer bestimmten Temperatur bildet es zuerst eine ungesättigte Lösung und dann eine gesättigte Lösung und schließlich die übersättigte Lösung.
Beispiel: Salz in Wasser auflösen
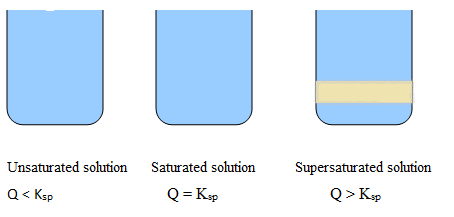 Ungesättigte Lösung: Weniger Salzmenge in Wasser, klare Lösung, kein Niederschlag.
Ungesättigte Lösung: Weniger Salzmenge in Wasser, klare Lösung, kein Niederschlag.
Gesättigte Lösung: Die maximale Salzmenge wird in Wasser gelöst, die Farbe der Lösung ändert sich leicht, aber kein Niederschlag.
Übersättigte Lösung: Mehr Salz wird in Wasser gelöst, die trübe Lösung, der Niederschlag ist sichtbar.
Bild mit freundlicher Genehmigung:
"Rock-Candy-Sticks" von Evan-Amos-eigene Arbeit. (CC BY-SA 3.0) über Commons


