Unterschied zwischen der ersten und dritten Übergangsserie
Der Schlüsselunterschied Zwischen der ersten und dritten Übergangsserie ist das Das äußerste D -Orbital der ersten Elemente der ersten Übergangsserie ist 3D, während die äußerste D -Orbital -zweite Übergangsserie 4D ist und das äußerste D -Orbital in der dritten Übergangsserie 5D ist.
Ein Übergangsmetall ist ein chemisches Element, das ein teilweise gefülltes D -Orbital hat. In der periodischen Elementtabelle gibt es drei Reihe von Übergangselementen; Wir nennen sie als erste, zweite und dritte Übergangsserie. Dies sind chemische Elemente von drei verschiedenen Perioden in der Periodenzüchtertabelle. Daher enthalten sie verschiedene äußerste Orbitale.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die erste Übergangsserie
3. Was ist die zweite Übergangsserie
4. Was ist die dritte Übergangsserie
5. Nebenseitiger Vergleich - Erste gegen zweite gegen dritte Übergangsreihe in tabellarischer Form
6. Zusammenfassung
Was ist die erste Übergangsserie?
Die erste Übergangsserie ist die Liste der chemischen Elemente, die von Skandium bis Kupfer reichen. Wir können sie auch als Übergangsmetalle in der ersten Reihe beschreiben, da dies in der ersten Periode des D-Blocks Metalle sind. Bei der Betrachtung der Elektronenkonfiguration dieser Elemente haben alle diese Elemente 3D- und 4S -Elektronen. Dies bedeutet, dass die äußersten D -Orbitale dieser Elemente 3D -Orbitale sind. Darüber hinaus enthalten die Elemente dieser Serie eine vollständige Argon -Elektronenkonfiguration mit 3D- und 4S -Elektronen.
Abbildung 01: Periodische Tabelle der Elemente
Chemische Elemente in der ersten Übergangsserie
Die Liste der chemischen Elemente in dieser Serie lautet wie folgt:
- Skandium
- Titan
- Vanadium
- Chrom
- Mangan
- Eisen
- Kobalt
- Nickel
- Kupfer
Was ist die zweite Übergangsserie?
Die zweite Übergangsserie ist die Liste der chemischen Elemente, die von Yttrium bis Silver reichen. Wir können sie auch als Übergangsmetalle in der zweiten Reihe nennen, weil sie sich in der zweiten Periode des D-Blocks befinden und Metalle sind. Die Elektronenkonfigurationen dieser Elemente haben 4D- und 5S -Orbitale; Daher sind die äußersten D -Orbitale 4D -Orbitale. Darüber hinaus enthalten die Elemente dieser Serie eine vollständige Krypton -Elektronenkonfiguration mit 4D- und 5S -Elektronen. Die Mitglieder dieser Liste sind wie folgt:
Chemische Elemente in der zweiten Übergangsserie
- Yttrium
- Zirkonium
- Niob
- Molybdän
- Technetium
- Ruthenium
- Rhodium
- Palladium
- Silber
Was ist die dritte Übergangsserie?
Die dritte Übergangsserie ist die Liste der chemischen Elemente von Hafnium bis Gold sowie Lanthan. Diese befinden sich in der dritten Periode des D -Blocks und enthält auch das erste Mitglied der Lanthanid -Serie (Lanthanum). Darüber hinaus enthalten die Elemente dieser Serie eine vollständige Xenon -Elektronenkonfiguration mit 5D- und 6S -Elektronen.

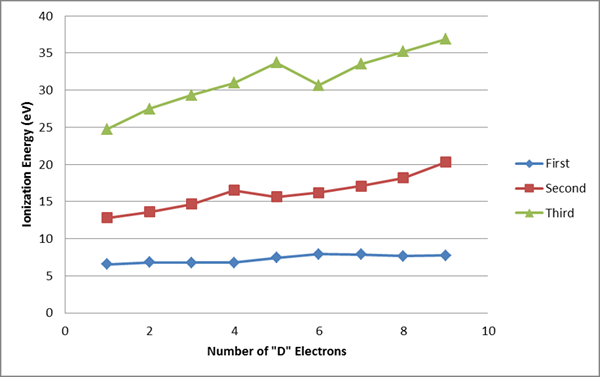
Abbildung 02: ionisierende Energien der ersten, zweiten und dritten Übergangselemente
Chemische Elemente in der dritten Übergangsserie
- Lanthan
- Hafnium
- Tantal
- Wolfram
- Rhenium
- Osmium
- Indium
- Platin
- Gold
Was ist der Unterschied zwischen der ersten und dem dritten Übergangsserie?
In der periodischen Elementtabelle gibt es drei Reihe von Übergangselementen, die wir als erste, zweite und dritte Übergangsserie nennen. Der wichtigste Unterschied zwischen der ersten und dritten Übergangsserie der ersten und dritten Übergang besteht darin.
Darüber hinaus ist die erste Übergangsserie die Liste der chemischen Elemente, die von Skandium zu Kupfer reichen. Die zweite Übergangsserie ist die Liste der chemischen Elemente, die von Yttrium bis Silver reichen, während die dritte Übergangsserie die Liste der chemischen Elemente von Hafnium bis Gold sowie Lanthanum ist. Unter diesen drei Serien haben die zweite und dritte Übergangsserie eng verwandte Eigenschaften, die sich erheblich von den Eigenschaften der ersten Übergangsserie unterscheiden.
Darüber hinaus enthalten die Elemente der ersten Übergangsserie eine vollständige Argonelektronenkonfiguration mit 3D- und 4S -Elektronen. Die zweite Übergangsserie enthält jedoch eine vollständige Krypton -Elektronenkonfiguration mit 4D- und 5S -Elektronen. In der Zwischenzeit enthält die Elemente der dritten Übergangsserie eine vollständige Xenon -Elektronenkonfiguration mit 5D- und 6S -Elektronen. Dies ist also auch ein signifikanter Unterschied zwischen der ersten und dem dritten Übergangsserie des zweiten und der dritten Übergangs.
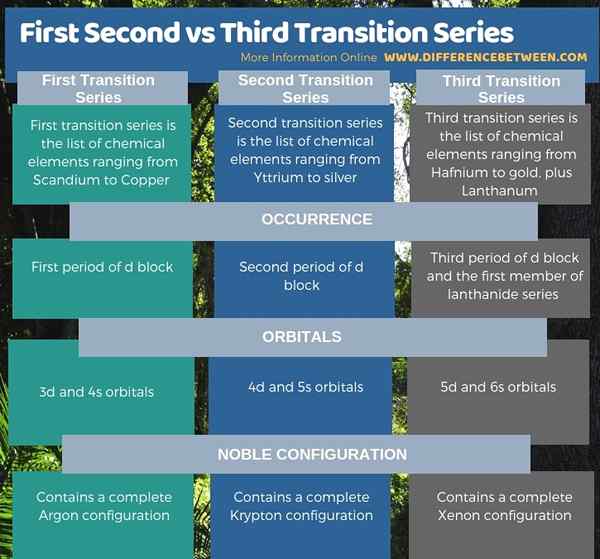
Zusammenfassung -Erste gegen zweite gegen dritte Übergangsserie
In der periodischen Elementtabelle gibt es drei Reihe von Übergangselementen; Wir nennen sie als erste, zweite und dritte Übergangsserie. Der wichtigste Unterschied zwischen der ersten und dritten Übergangsserie der ersten und dritten Übergang besteht darin.
Referenz:
1. „23.1: Allgemeine Eigenschaften von Übergangsmetallen.”Chemistry Libretexten, Libretexte, 18. September. 2019, hier erhältlich.
2. „Dritte Übergangsserie (oder) 5D-Serie.Einfach Wissenschaft, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Übergangsmetalle -Ionisierungsenergien" von OnCandor - eigener Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Einfacher Periodenabschnittstabelle -Diagramm von Offnfopt - eigener Arbeit (Public Domain) über Commons Wikimedia


