Unterschied zwischen formeller Ladung und Oxidationszustand
Der Schlüsselunterschied Zwischen formaler Ladung und Oxidationszustand ist das Formale Ladung ist die Ladung eines Atoms in einem Molekül, das wir berechnen, vorausgesetzt, dass Elektronen in chemischen Bindungen gleich zwischen Atomen geteilt werden, während der Oxidationszustand die Anzahl der Elektronen ist, die ein Atom verliert oder Gewinne oder Aktien mit einem anderen Atom.
Formelle Ladung und Oxidationszustand sind unterschiedliche Begriffe, obwohl wir normalerweise davon ausgehen, dass sie gleich sind. Die formale Ladung bestimmt die Anzahl der Elektronen, die um ein Atom eines Moleküls auftreten, während der Oxidationszustand die Anzahl der Elektronen bestimmt, die während der Bildung eines Moleküls zwischen den Atomen ausgetauscht werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist formelle Gebühr
3. Was ist Oxidationszustand
4. Seite an Seitenvergleich - formelle Ladung gegen den Oxidationszustand in tabellarischer Form
5. Zusammenfassung
Was ist formelle Gebühr?
Die formale Ladung ist die Ladung eines Atoms in einem Molekül, das wir berechnen, vorausgesetzt. Bei der Bestimmung der formalen Ladung vergleichen wir daher die Anzahl der Elektronen um ein neutrales Atom und die Anzahl der Elektronen um dieses Atom, wenn es sich in einem Molekül befindet. Bei dieser Bestimmung der formalen Ladung müssen wir die Elektronen des Moleküls einzelne Atome zuweisen. Hier müssen wir auch die folgenden Anforderungen berücksichtigen
- Wir müssen dem Atom, in dem die nicht gebundenen Elektronen auftreten, nicht gebundene Elektronen zuweisen
- Wir müssen die Bindungselektronen gleichermaßen zwischen den gemeinsamen Atomen teilen
Die mathematische Beziehung für diese Berechnung ist wie folgt:
Formale Ladung = (Anzahl der Valenzelektronen im neutralen Atom) - (Anzahl der einsamen Paarelektronen) - (1/2*Bondpaarelektronen)
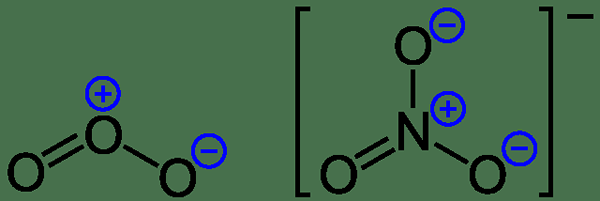
Abbildung 1: formelle Gebühren für Ozon und Nitratanion
Betrachten wir ein Beispiel, um dieses Phänomen zu verstehen. Für Ammoniakmolekül gibt es drei N-H-Bindungen und ein einsames Elektronenpaar am Stickstoffatom. Wann kann dann die Follower berechnet werden;
Formelle Ladung von n = 5 - 2 - 1/2*6 = 0
Formelle Ladung von H = 1 - 0 - 1/2*2 = 0
Was ist Oxidationszustand?
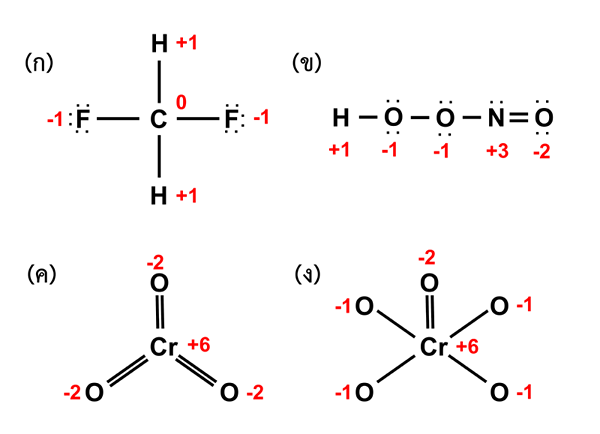
Der Oxidationszustand ist die Anzahl der Elektronen, die ein bestimmtes Atom mit einem anderen Atom verlieren, gewinnen oder teilen kann. Dieser Begriff wird auf jedes chemische Element in Molekülen angewendet (der Begriff Oxidationsnummer wird hauptsächlich auf zentrale Metallatome von Koordinationskomplexen angewendet, obwohl wir diese Begriffe austauschbar verwenden). Der Oxidationszustand gibt tatsächlich den Oxidationsgrad eines Atoms in einer Verbindung an. Wir sollten immer den Oxidationszustand als Ganzes geben, und er ist in hinduistischen Arabischen Zahlen, einschließlich der Ladung des Atoms, dargestellt. Zum Beispiel beträgt der Oxidationszustand von Eisen in Feo +2.

Abbildung 02: Oxidationszustände von Atomen in verschiedenen Molekülen
Tipps zur Bestimmung des Oxidationszustands:
- Der Oxidationszustand eines einzelnen Elements ist Null (dies schließt auch die Moleküle aus einem einzelnen Element ein).
- Die Gesamtladung eines Moleküls oder eines Ions ist die Summe der Ladungen jedes Atoms.
- Der Oxidationszustand von Alkali -Metallen beträgt immer +1 und für Alkali -Erdmetalle +2.
- Inzwischen beträgt der Oxidationszustand von Fluor immer -1.
- Ferner beträgt der Oxidationszustand von Wasserstoff normalerweise +1. Aber manchmal ist es -1 (wenn es an Alkali- oder Alkali -Erdmetalle gebunden ist.)
- Auch im Allgemeinen beträgt der Oxidationszustand von Sauerstoff -2 (aber in Peroxiden und Superoxiden kann er variieren).
- Das elektronegativste Atom in einem Molekül erhält die negative Ladung, und das andere erhält die positive Ladung.
Der Oxidationszustand ist sehr nützlich für die Bestimmung von Produkten bei Redoxreaktionen. Redoxreaktionen sind chemische Reaktionen, die den Elektronenaustausch zwischen Atomen umfassen. Bei Redoxreaktionen treten zwei Halbreaktionen gleichzeitig parallel auf. Einer ist die Oxidationsreaktion, und der andere ist die Reduktionsreaktion. Die Oxidationsreaktion beinhaltet den Zunahme des Oxidationszustands eines Atoms, während eine Reduktionsreaktion die Abnahme des Oxidationszustands eines Atom.
Was ist der Unterschied zwischen formaler Ladung und Oxidationszustand?
Der Hauptunterschied zwischen formaler Ladung und Oxidationszustand besteht darin, dass die formale Ladung die Ladung eines Atoms in einem Molekül ist, das wir unter der Annahme berechnen, dass Elektronen in chemischen Bindungen gleichermaßen zwischen Atomen geteilt werden, während der Oxidationszustand die Anzahl der Elektronen ist, die ein Atom verliert oder gewinnt oder erhöht oder teilt mit einem anderen Atom. Zum Beispiel beträgt die formale Ladung des Stickstoffatoms im Ammoniakmolekül 0, während der Oxidationszustand +3 beträgt.
Nach der Infografik fasst die Differenz zwischen formaler Ladung und Oxidationszustand zusammen.

Zusammenfassung -formelle Gebühr gegen Oxidation
Formelle Anklage- und Oxidationszustand sind unterschiedliche Begriffe, obwohl einige Leute davon ausgehen, dass sie gleich sind. Der Hauptunterschied zwischen formaler Ladung und Oxidationszustand besteht darin, dass die formale Ladung die Ladung eines Atoms in einem Molekül ist, das wir unter der Annahme berechnen, dass Elektronen in chemischen Bindungen gleichermaßen zwischen Atomen geteilt werden, während der Oxidationszustand die Anzahl der Elektronen ist, die ein Atom verliert oder gewinnt oder erhöht oder teilt mit einem anderen Atom.
Referenz:
1. “2.3: formelle Gebühren.” Chemie -Libretexten, Libretexten, 25. Juli 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Formales Gebührenprinzip v.1 ”von Jü - eigene Arbeit (öffentlich zugänglich) über Commons Wikimedia
2. "Oxidationszustandszuordnungen" von Saranphong Yimklan - eigene Arbeit (Public Domain) über Commons Wikimedia


