Unterschied zwischen freiem Radikal und Ion
Der Schlüsselunterschied zwischen freiem Radikal und Ion ist, dass die Freie Radikale haben ein oder mehrere ungepaarte Elektronen, aber Ionen haben gepaarte Elektronen.
Wir können den Unterschied zwischen freiem Radikal und Ion von den grundlegenden Eigenschaften eines Ions und einem freien Radikal erklären. Ein Ion kann als Molekül oder Atom mit einer Ladung (positiv oder negativ) aufgrund des Verlusts oder des Gewinns eines Elektrons auftreten. Ionen halten eine negative Ladung aufgrund eines Elektronsgewinns und eine positive Ladung aufgrund des Verlusts eines Elektrons. Ionen können als Einzel- oder Multi-geladene chemische Spezies auftreten, abhängig von der Anzahl der gewonnenen oder verlorenen Elektronen. Freie Radikale sind Moleküle oder Atome mit mindestens ein ungepaarter Elektron. In diesem Artikel geht es um den Unterschied zwischen freiem Radikal und Ion, einschließlich ihrer besonderen Merkmale.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist freie Radikale
3. Was ist Ion
4. Nebenseitiger Vergleich - freies Radikal gegen Ion in tabellarischer Form
5. Zusammenfassung
Was ist freie Radikale?
Ein freies Radikal ist ein Atom oder eine Gruppe von Atomen, die eine oder mehrere ungepaarte Elektronen enthalten). Sie sind aufgrund des Vorhandenseins eines ungepaarten Elektrons hochreaktiv. Freie Radikale sind sehr instabil und versuchen, Stabilität zu erlangen, indem sie das erforderliche Elektron akzeptieren. Sie reagieren mit anderen chemischen Verbindungen, indem sie das benötigte Elektron erfassen. Freie Radikale sind wichtige Zwischenprodukte in natürlichen Prozessen. Wir können freie Radikale durch einen Superscript -Punkt nach rechts bezeichnen. Zum Beispiel h., Cl., Ho., H3c.
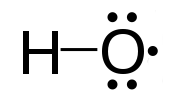
Abbildung 01: Das Hydroxylradikal
Langlebige freie Radikale befinden sich in drei Kategorien: stabile Radikale, anhaltende Radikale und DI-Radikale.
- Stabile Radikale: Das Hauptbeispiel eines stabilen Radikals ist molekularer Sauerstoff o2. Organische Radikale, die konjugiertes π -System enthalten.
- Anhaltende Radikale: Sie sind langlebig aufgrund des sterischen Umschlag.
- DI-Radikale: Einige Moleküle haben zwei radikale Zentren, wir nennen sie als DI-Radikale. Molekularer Sauerstoff natürlich (atmosphärischer Sauerstoff) existiert als Diradikaler.
Was ist Ion?
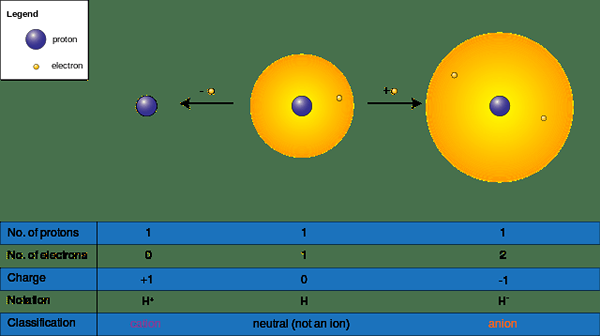
Ionen können sich bilden, wenn eine chemische Spezies bei chemischen Reaktionen Elektronen gewinnt oder verliert; Sie haben eine positive (+) oder negative (-) Ladung. Diese erhalten eine negative Ladung, indem sie ein Elektronen (en) und eine positive Ladung akzeptieren, indem sie Elektronen an ein Elektronenmangel -Molekül oder ein Element spenden. Akzeptieren oder Spenden von Elektronen beeinflussen direkt die Größe des Ions; Es verändert die molekulare Größe dramatisch. Wir nennen ein Atom oder eine Gruppe von Atomen ohne negative oder positive Ladung als „neutral“; Um ein neutrales Atom oder ein Molekül zu werden, muss die Anzahl der Protonen mit einer Reihe von Elektronen übereinstimmen.
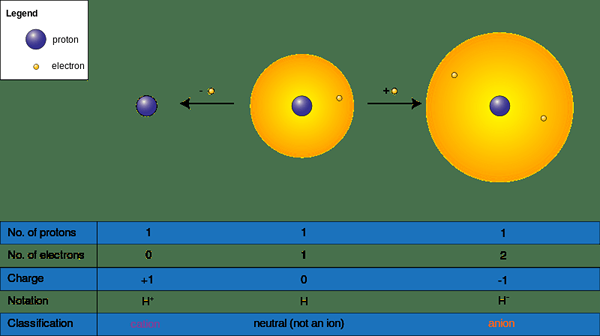
Abbildung 02: Kation und Anionenbildung
Daher gibt es zwei Formen von Ionen wie folgt.
- Kationen oder (+) Ionen - Oft kommt Metalle in diese Kategorie, da Metalle Elektronen verlieren, um positiv (+) aufgeladen zu werden (NA+, Ba2+, Ca2+, Al3+)
- Anionen (-) Ionen - Oft werden Nichtmetalle in diese Kategorie eingehen, da Nichtmetalleer Elektronen zum negativen (-) geladen werden (CL)-, S2-, Ö2-, Br-)
Was ist der Unterschied zwischen freiem Radikal und Ion?
Der Hauptunterschied zwischen freiem Radikal und Ion besteht darin, dass die freien Radikale ein oder mehrere ungepaarte Elektronen haben, Ionen jedoch gepaarte Elektronen haben. Daher sind freie Radikale sehr instabil, während Ionen relativ stabil sind. Daher ist dies auch ein signifikanter Unterschied zwischen freiem Radikal und Ion. Radikale können jedoch selbst existieren, während die meisten Ionen mit entgegengesetzt geladenen Ionen kombiniert werden. Wenn Sie mehr über ihre Stabilität nachdenken, werden freie Radikale durch Akzeptieren von Elektronen stabil, aber Ionen sind stabil, wenn sie Komplexe mit entgegengesetzt geladenen Verbindungen bilden.
Ein weiterer wichtiger Unterschied zwischen freiem Radikal und Ion besteht darin, dass die Ionen immer eine Ladung haben, aber freie Radikale sind keine geladenen Arten, selbst wenn sie ungepaarte Elektronen haben. Dieser Unterschied entsteht, weil in einem Ion die Gesamtzahl der Elektronen immer nicht gleich der Anzahl der Protonen im Kern ist, während in einem freien Radikal die Anzahl der Elektronen gleich der Anzahl der Protonen entspricht.
Die folgende Infografik enthält mehr Details zu dem Unterschied zwischen freiem Radikal und Ion.
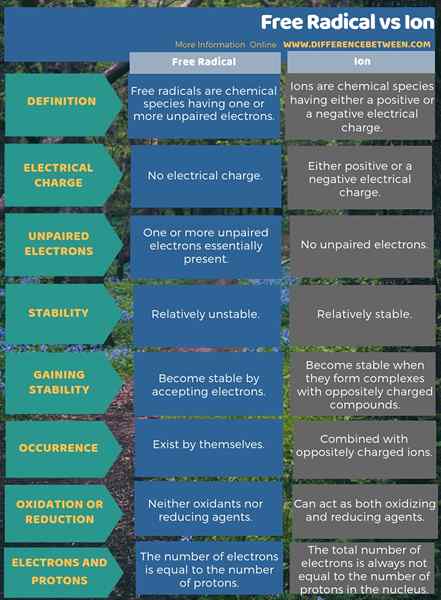
Zusammenfassung -freie Radikale gegen Ion
Wir können sowohl die Begriffe, freien Radikale als auch die Ionen unter Verwendung der Anzahl der Elektronen einer bestimmten Art beschreiben. Hier ist der größte Unterschied zwischen freien Radikalen und Ionen, dass die freien Radikale ungepaarte Elektronen haben, aber Ionen gepaarte Elektronen haben. Somit sind freie Radikale reaktiver. Andererseits werden Ionen chemisch stabil, indem sie Verbindungen mit entgegengesetzt geladenen Ionen/Molekülen bilden.
Referenz:
1. „Radikal (Chemie).Wikipedia, Wikimedia Foundation, 8. Oktober. 2018. Hier verfügbar
2. "Ion.Wikipedia, Wikimedia Foundation, 16. Oktober. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Hydroxylradikal" von Smokeyjoe - eigene Arbeit (CC BY -SA 4).0) über Commons Wikimedia
2."Ionen" von jkwchui - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


